题目内容
11.向盛有白糖的小烧杯中加几滴水搅拌均匀,在滴入浓硫酸,白糖变黑,并迅速膨大,俗称“黑面包”,同时又气体逸出,若将该气体通入澄清石灰水中,有白色沉淀生成,下列叙述中不正确的是( )| A. | 浓硫酸的作用,脱水剂、强氧化剂 | B. | “黑面包”的主要成分:C | ||
| C. | 气体的主要成分:SO2、CO2 | D. | 白色沉淀只有CaCO3 |
分析 蔗糖中含有C、H、O元素,浓硫酸具有脱水性,使蔗糖炭化,且浓硫酸和C发生氧化还原反应生成二氧化硫、二氧化碳和水,二氧化碳、二氧化硫都能使澄清石灰水变浑浊,据此分析解答.
解答 解:A.浓硫酸将蔗糖中的H、O以2:1水的形式脱去而体现脱水性,C和浓硫酸反应生成二氧化硫、二氧化碳和水,浓硫酸体现强氧化性,故A正确;
B.浓硫酸将蔗糖中的H、O以2:1水的形式脱去而生成C,所以黑面包主要成分是C,故B正确;
C.根据A知,气体的主要成分是二氧化硫、二氧化碳,故C正确;
D.二氧化碳、二氧化硫都能和氢氧化钙反应生成沉淀,所以沉淀成分是CaCO3、CaSO3,故D错误;
故选D.
点评 本题考查浓硫酸的性质,浓硫酸具有吸水性、脱水性和强氧化性,明确该反应中浓硫酸的性质是解本题关键,注意不能利用澄清石灰水鉴别二氧化碳和二氧化硫,为易错点.

练习册系列答案
相关题目
1.试推测该有机物CH3CH(OH)CH=CHCOOH不可能具有的性质是( )
| A. | 能与碳酸钠反应产生气体 | B. | 能被酸性高锰酸钾氧化 | ||
| C. | 能发生酯化反应 | D. | 能发生水解反应 |
19.可逆反应在一定条件下达到化学平衡状态的标志是( )
| A. | 反应停止了 | B. | 正反应速率与逆反应速率相等 | ||
| C. | 反应物和生成物浓度相等 | D. | 正反应速率与逆反应速率均为零 |
6.汽车尾气中NO,是造成大气污染的物质之一,但NO又是工业生产硝酸的中间产物,另外NO在人体中的血管内又有传送信息的功能,下列有关NO的说法正确的是( )
| A. | NO是一种红棕色气体,易溶于水 | |
| B. | 汽车尾气中NO的来源是空气中的N2与O2在汽车气缸内的高温环境下的反应产物 | |
| C. | 工业生产硝酸的原料主要有NO和空气 | |
| D. | 由于NO在血管中的特殊作用,所以NO无毒 |
16.下列实验的原理分析中,正确的是( )
| A. | 将SO2通入品红溶液或者溴水都能使它们褪色,均说明SO2具有漂白性 | |
| B. | 蘸有浓氨水和蘸有浓HNO3的玻璃棒靠近时有白烟产生,是因为氨气有还原性 | |
| C. | 某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,说明溶液中一定没有NH4+ | |
| D. | NH3•H2O的热不稳定性可以解释实验室中用加热氨水的办法制取氨气 |
3.下列说法正确的是( )
| A. | HA溶液的导电性较弱,则HA为弱酸 | |
| B. | S02的水溶液能导电,则S02为电解质 | |
| C. | HC1在水中能完全电离,则盐酸为强电解质 | |
| D. | BaS04是电解质,但其水溶液不导电 |
20.下列关于晶体结构的说法不正确的是( )
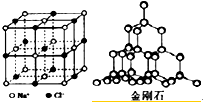

| A. | 在NaCl晶体中,距Na+最近的Cl-有6个 | |
| B. | 在NaCl晶体中,每个晶胞实际拥有4个Na+、4个Cl- | |
| C. | 在金刚石晶体中,碳原子与碳碳键的数目比为1:4 | |
| D. | 在金刚石晶体中,最小环是由6个碳原子构成 |
1.硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO.某探究性学习小组的同学设计如图实验方案,将硫酸渣中金属元素转化为氢氧化物沉淀分离开来.
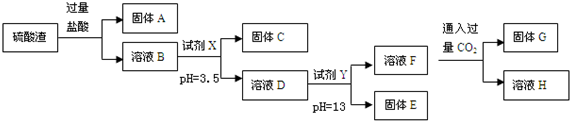
已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
(1)固体A的化学式为SiO2.
(2)向溶液F中通过量CO2发生反应的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(3)采用过滤操作分离固体E和溶液F,发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:漏斗液面高于滤纸的边缘、玻璃棒下端靠在滤纸的单层处,导致滤纸破损.
(4)上述流程中的试剂Y 最好选用下列的C(填字母编号)
A、氧化镁 B、氨水 C、氢氧化钾 D、氢氧化钡
(5)取w g硫酸渣(含SiO2 m g),与 c mol 盐酸恰好完全反应,则废渣中氧元素的质量分数为$\frac{8m+120c}{15w}$.(用含w、m、c的代数式表示)

已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如表:
| 阳离子 | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
| 沉淀完全时的pH | 3.2 | 5.2 | 11.0 |
(2)向溶液F中通过量CO2发生反应的离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(3)采用过滤操作分离固体E和溶液F,发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:漏斗液面高于滤纸的边缘、玻璃棒下端靠在滤纸的单层处,导致滤纸破损.
(4)上述流程中的试剂Y 最好选用下列的C(填字母编号)
A、氧化镁 B、氨水 C、氢氧化钾 D、氢氧化钡
(5)取w g硫酸渣(含SiO2 m g),与 c mol 盐酸恰好完全反应,则废渣中氧元素的质量分数为$\frac{8m+120c}{15w}$.(用含w、m、c的代数式表示)
 某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小.
某铵态氮肥由W、X、Y、Z 4种短周期元素组成,其中W的原子半径最小.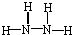 ;
; ;
;