题目内容
15.下列组成和结构都相同的是( )| A. | 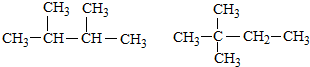 | |
| B. | 液氯、氯气 | |
| C. | O2、O3 | |
| D. | ${\;}_{17}^{35}Cl$、${\;}_{17}^{37}Cl$ |
分析 A、分子式相同,结构不同的有机物互为同分异构体;
B、液氯为氯气的液体状态;
C、氧气和臭氧是同种元素形成的不同种单质;
D、质子数相同,中子数不同的互为同位素,据此解答即可.
解答 解:组成和结构都相同的属于同种物质,
A、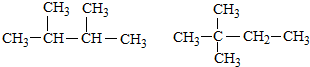 两者分子式相同,结构不同,互为同分异构体,故A错误;
两者分子式相同,结构不同,互为同分异构体,故A错误;
B、液氯是氯气的液体状态,与氯气是同种物质,结构与组成相同,故B正确;
C、O2、O3均是O元素形成的单质,两者互为同素异形体,故C错误;
D、两者质子数相同,中子数不同,互为同位素,故D错误,故选B.
点评 本题主要考查的是同分异构体、同位素以及同素异形体等的概念,难度不大.

练习册系列答案
相关题目
18.在标准状况下,相同质量的下列气体中体积最小的是( )
| A. | Cl2 | B. | N2 | C. | H2 | D. | CO2 |
20.关于物质的分离、除杂方法不正确的是( )
| A. | 通过萃取、分液将乙醇和水分离 | |
| B. | 通过蒸馏将海水淡化 | |
| C. | 通过加热除去固体碳酸钠中混有的碳酸氢钠 | |
| D. | 通过溶解、过滤除去粗盐中的泥沙 |
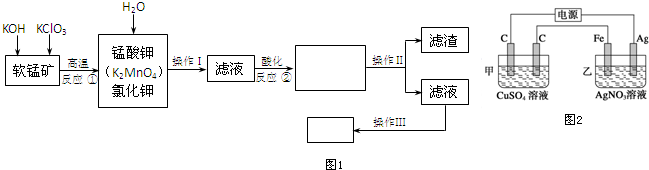
4.铝灰是电解铝或铸造铝生产工艺中产生的熔渣经冷却加工后的产物,其作用成分为金属铝、三氧化二铝、二氧化硅及少量的氧化亚铁、氧化铁等.用铝灰制备Al2(SO4)3•18H2O,工艺流程如下(部分操作或条件略):
Ⅰ.向铝灰中加入过量稀硫酸,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,然后调节溶液的PH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
已知:生成氢氧化物沉淀与PH的关系
(1)写出步骤Ⅱ中加入过量KMnO4溶液时发生反应的离子方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O
(2)已知:一定条件下,MnO4-与Mn2+反应生成MnO2.
①向步骤Ⅲ产生的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
(3)对Al2(SO4)3粗产品进行定量分析,步骤如图所示:
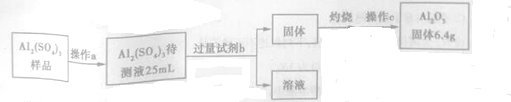
①操作c是称量,所需仪器名称为托盘天平.
②加入试剂b后发生反应的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
③配制的Al2(SO4)3的待测液中c(Al3+)=5.0mol/L.(保留两位有效数字)
Ⅰ.向铝灰中加入过量稀硫酸,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,然后调节溶液的PH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ.浓缩、结晶、分离,得到产品.
已知:生成氢氧化物沉淀与PH的关系
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(2)已知:一定条件下,MnO4-与Mn2+反应生成MnO2.
①向步骤Ⅲ产生的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是生成黄绿色气体.
②Ⅳ中加入MnSO4的目的是除去过量的MnO4-.
(3)对Al2(SO4)3粗产品进行定量分析,步骤如图所示:

①操作c是称量,所需仪器名称为托盘天平.
②加入试剂b后发生反应的离子方程式为Al3++3NH3•H2O═Al(OH)3↓+3NH4+.
③配制的Al2(SO4)3的待测液中c(Al3+)=5.0mol/L.(保留两位有效数字)
5.下列离子方程式正确的是( )
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 小苏打与氢氧化钠溶液混合:HCO3-+OH-═CO2↑+H2O | |
| C. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | |
| D. | 氧化亚铁溶液中加入稀硝酸:3FeO+10H++NO3-═3Fe3++NO↑+5H2O |
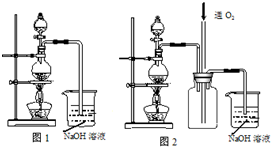 硫酸铜是一种应用极其广泛的化工原料.实验中可将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1所示).
硫酸铜是一种应用极其广泛的化工原料.实验中可将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1所示).