题目内容
20.关于物质的分离、除杂方法不正确的是( )| A. | 通过萃取、分液将乙醇和水分离 | |
| B. | 通过蒸馏将海水淡化 | |
| C. | 通过加热除去固体碳酸钠中混有的碳酸氢钠 | |
| D. | 通过溶解、过滤除去粗盐中的泥沙 |
分析 A.乙醇与水互溶;
B.海水中水的沸点较低;
C.碳酸氢钠加热分解生成碳酸钠;
D.泥沙不溶于水,食盐溶于水.
解答 解:A.乙醇与水互溶,则不能萃取、分液分离,应选蒸馏法,故A错误;
B.海水中水的沸点较低,则通过蒸馏将海水淡化,故B正确;
C.碳酸氢钠加热分解生成碳酸钠,则选择加热可除杂,故C正确;
D.泥沙不溶于水,食盐溶于水,则通过溶解、过滤除去粗盐中的泥沙,故D正确;
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、混合物分离提纯方法等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | 明矾可用于水的消毒、杀菌 | B. | NaHCO3可用于治疗胃酸过多 | ||
| C. | 浓硝酸保存于无色玻璃瓶中 | D. | 氢氟酸可保存于玻璃瓶中 |
8.NA表示阿伏伽德罗常数的值,下列有关说法正确的是( )
| A. | 标准状况下,22.4L的CH4和CH3CH2OH的混合物所含分子数为NA | |
| B. | 常温常压下,18g14CH4所含质子数目为10NA | |
| C. | 标准状况下的22.4L氯气与足量铁反应生成三氯化铁,转移的电子数目为3NA. | |
| D. | 0.1L 1mol/L的NH4C1溶液中存在的NH4+数目为0.1NA. |
15.下列组成和结构都相同的是( )
| A. | 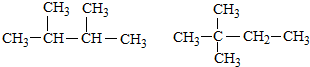 | |
| B. | 液氯、氯气 | |
| C. | O2、O3 | |
| D. | ${\;}_{17}^{35}Cl$、${\;}_{17}^{37}Cl$ |
12.可燃冰是天然气与水在一定条件下相互作用形成的晶体.据测定每0.1m3固体“可燃冰”能释放20m3的甲烷气体,则下列说法中不正确的是( )
| A. | 可燃冰释放的甲烷属于烃 | B. | 可燃冰是水变油,属于化学变化 | ||
| C. | 甲烷与异丁烷为同系物 | D. | 天然气是一种重要的化工原料 |
9.砷为第4周期ⅤA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是( )
| A. | 砷在通常情况下是固体 | |
| B. | 可以存在-3、+3、+5等多种化合物 | |
| C. | As2O5对应水化物的酸性比H3PO4强 | |
| D. | 砷的气态氢化物比磷的气态氢化物稳定性差 |
10.下列说法正确的是( )
| A. | 乙醛和丙烯醛(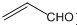 )是同系物 )是同系物 | |
| B. | HOCH2COOH的缩聚物是 | |
| C. | 已知甲醛分子中各原子共平面,则丙烯醛所有原子一定共平面 | |
| D. | 结构为…CH=CH-CH=CH-CH=CH-CH=CH…的高分子的单质是1,3-丁二烯 |

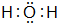 、
、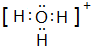 ;
;