题目内容
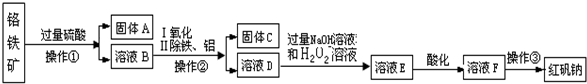
6. 硫酸铜是一种应用极其广泛的化工原料.实验中可将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1所示).
硫酸铜是一种应用极其广泛的化工原料.实验中可将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1所示).(1)配制质量分数20%的硫酸需要100mL 98%的浓硫酸(密度为1.84g/cm3)和717.6ml蒸馏水.配制所需仪器除烧杯、量筒、胶头滴管外,还需要的仪器玻璃棒.
(2)图2是图1的改进装置,为符合绿色化学的要求,某研究性学习小组进行如下设计:
方案1:以空气为氧化剂.将铜粉在某仪器A中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.反应后,过滤、蒸发、结晶等,用少量95%的酒精淋洗后晾干,得CuSO4•5H2O晶体.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加Fe2(SO4)3,即发生反应.反应完全后向其中先加物质甲、后加物质乙,取样检验后,过滤、蒸发、结晶,滤渣可循环使用.[已知Fe(OH)2、Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为9.6、3.7、6.4.]
(3)方案1中的A仪器名称是坩埚.
(4)方案2中物质甲可以是f (选填答案编号,下同),物质乙可以是bc.
a.Cu b.CuCO3 c.CuO d.氨水 e.氯水 f.双氧水
(5)用铜粉制硫酸,上述方案1、方案2都不是十分理想,一种更符合绿色化学理念的是在氧气存在时用热稀硫酸与铜反应,其化学方程式是:2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O.
分析 (1)100mL 98%的浓硫酸(密度为1.84g/cm3)的质量为100mL×1.84g/mL=184g,其中m(H2SO4)=184g×98%=180.32g,配制成质量分数20%的硫酸后溶液的质量为$\frac{180.32g}{20%}$=901.6g,以此可计算需要水的质量和体积;
(2)方案1中,将铜在坩埚中灼烧生成氧化铜,氧化铜与稀硫酸反应生成硫酸铜;
方案2中,铜与硫酸铁反应生成硫酸铜、硫酸亚铁,加入过氧化氢,氧化亚铁离子生成硫酸铁,然后加入氧化铜、碳酸铜等可除去铁离子,过滤、蒸发、结晶得到硫酸铜晶体,以此解答(3)、(4)(5)等题.
解答 解:(1)100mL 98%的浓硫酸(密度为1.84g/cm3)的质量为100mL×1.84g/mL=184g,其中m(H2SO4)=184g×98%=180.32g,配制成质量分数20%的硫酸后溶液的质量为$\frac{180.32g}{20%}$=901.6g,需要水的质量为901.6g-184g=717.6g,体积为717.6mL,配制所需仪器除烧杯、量筒、胶头滴管外,还需要的仪器有玻璃棒,
故答案为:717.6;玻璃棒;
(3)加热固体应在坩埚中进行,故答案为:坩埚;
(4)铜与硫酸铁反应生成硫酸铜、硫酸亚铁,加入过氧化氢,氧化亚铁离子生成硫酸铁,然后加入氧化铜、碳酸铜等可除去铁离子,过滤、蒸发、结晶得到硫酸铜晶体,
故答案为:f;bc;
(5)可加入过氧化氢,在加热条件下与铜、稀硫酸反应生成硫酸铜,反应的化学方程式为2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O,
故答案为:2Cu+O2+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O.
点评 本题考查物质的制备实验方案的设计与评价,为高考常见题型,侧重于学生的分析、实验和计算能力的考查,注意把握物质的性质以及制备原理,把握实验方法,难度中等.

| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 | Cl- CO32- NO3 - SO42- I- |
Ⅰ.取该无色溶液5mL,滴加一滴氨水有沉淀生成,且离子种类增加.
Ⅱ.用铂丝蘸取溶液,在火焰上灼烧,透过蓝色钴玻璃观察,无紫色火焰.
Ⅲ.另取溶液加入过量盐酸,有无色气体生成,该无色气体遇空气变成红棕色.
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2 溶液,有白色沉淀生成.
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、NH4+、Cu2+.
(2)Ⅲ中加入盐酸生成无色气体的离子方程式是6I-+2NO3-+8H+═3I2+2NO↑+4H2O.
(3)甲同学最终确定原溶液中所含阳离子有Mg2+、Al3+,阴离子有Cl-、I-、NO3-、SO42-;并据此推测原溶液应该呈酸性,原因是Mg2++2H2O?Mg(OH)2+2H+、Al3++3H2O?Al(OH)3+3H+(用离子方程式说明).
(4)另取100mL原溶液,加入足量的NaOH溶液,此过程中涉及的离子方程式为Mg2++2OH-═Mg(OH)2↓、Al3++4OH-═AlO2-+2H2O.充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为0.4g.
| A. | 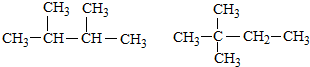 | |
| B. | 液氯、氯气 | |
| C. | O2、O3 | |
| D. | ${\;}_{17}^{35}Cl$、${\;}_{17}^{37}Cl$ |
 实验室利用如图装置进行中和热的测定.回答下列问题:
实验室利用如图装置进行中和热的测定.回答下列问题: