题目内容
【题目】根据下列实验操作和现象能推出相应结论的是
选项 | 实验操作和现象 | 结论 |
A | 向NaAlO2溶液中滴加NaHCO3 溶液,产生白色沉淀 | AlO2-与HCO3-发生了相互促进的水解反应 |
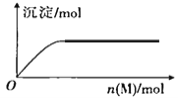
B | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | X不一定具有氧化性 |
C | 灼热的木炭加入浓硝酸中,放出红棕色气体 | 一定是木炭与浓硝酸反应生成了NO2 |
D | 将乙醇与浓硫酸共热,制得的气体直接通入酸性KMnO4溶液中,酸性KMnO4溶液褪色 | 说明制得的气体中含有乙烯 |
A. A B. B C. C D. D
【答案】B
【解析】
A.向NaAlO2溶液中滴加NaHCO3 溶液,产生白色沉淀,是因为Ka2(H2CO3)![]() Ka(HAlO2),反应AlO2-
Ka(HAlO2),反应AlO2-![]() HCO3-
HCO3-![]() H2O=Al(OH)3
H2O=Al(OH)3![]() CO32-,故A错误;
CO32-,故A错误;
B.向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀,若气体X是氧化性气体,最后生成的是BaSO4沉淀,若气体X是碱性气体,最后生成的是BaSO3沉淀,故B正确;
C.灼热的木炭加入浓硝酸中,放出红棕色气体,可能是木炭和浓硝酸反应产生的NO2,也可能是浓硝酸受热分解产生的NO2,故C错误;
D.乙醇与浓硫酸共热,乙醇易挥发,乙醇也能被高锰酸钾氧化,使高锰酸钾溶液褪色,故D错误;
本题答案为B。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】下表为元素周期表的一部分,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
四 | ⑨ | ⑩ |
(1)写出元素符号:②________,⑦_______。
(2)①的原子结构示意图为_________,⑤的离子结构示意图为________。
(3)元素⑨的最高价氧化物对应的水化物的电子式为________。
(4)元④、⑧、⑩的氢化物的沸点由高到低的顺序为_________(填化学式)。
(5)写出元素③和⑥形成的化合物与元素⑤的最高价氧化物对应的水化物反应的化学方程式_____________。