题目内容
【题目】短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如表:
元素编号 | 元 素 特 征 信 息 |
A | 最外层电子数是次外层电子数的2倍 |
B | 和E同主族 |
C | 1 mol C单质能与冷水反应,在标准状况下生成11.2 L H2 |
D | 原子最外层电子数等于其周期序数 |
E | 负一价阴离子的电子层结构与Ar原子相同 |
(1)D原子结构示意图为: _____ __ ,E在周期表中的位置为: 。
(2)B和C形成的化合物的电子式为: 。
(3)B和D简单离子的半径大小为: 。
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是: (填序号)。
A.比较两种单质的颜色 B.比较两种单质与H2化合的难易程度
C.依据两元素在周期表中的位置 D.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比1∶4,相对分子质量为154,则该物质的化学式为: 。
【答案】(1)![]() 第三周期第ⅦA族;(2)
第三周期第ⅦA族;(2)![]() (3)F->Al3+;(4)a、e(5)CCl4
(3)F->Al3+;(4)a、e(5)CCl4
【解析】试题分析:短周期元素A、B、C、D、E的原子序数依次增大,A最外层电子数是次外层电子数的2倍,A是C元素;1 mol C单质能与冷水反应,在标准状况下生成11.2 L H2,C是Na元素;D原子最外层电子数等于其周期序数,D是Al元素;E负一价阴离子的电子层结构与Ar原子相同,E是Cl元素;B和E同主族,B是F元素,(1)D是Al元素,其原子结构示意图为![]() ,Cl位于元素周期表中的第三周期第ⅦA族,答案为:
,Cl位于元素周期表中的第三周期第ⅦA族,答案为:![]() 第三周期第ⅦA族;(2)NaF的电子式为
第三周期第ⅦA族;(2)NaF的电子式为![]() ,答案为:
,答案为:![]() ;(3)Al3+和F-的核外电子排布相同,质子数越多半径越小,简单离子的半径大小为:F->Al3+ ,答案为F->Al3+ ; (4)元素非金属性强弱比较方法有:A.比较两种单质的颜色,a错误;B.比较两种单质与H2化合的难易程度,与H2化合越容易,非金属性越强,b正确;C.依据两元素在周期表中的位置,F和Cl同主族,非金属性逐渐减弱,c正确;D.比较对应阴离子的还原性,对应阴离子的还原性越强,单质的氧化性越弱,非金属性越弱,d正确;e.比较最高价氧化物对应水化物的酸性,最高价氧化物对应水化物的酸性越强,非金属性越强,但是F元素没有负化合价,没有最高价氧化的水化物,e错误,不可行的是a、e,答案为:(4)a、e ;(5) E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比1∶4,相对分子质量为154,该化合物是CCl4,答案为:CCl4
;(3)Al3+和F-的核外电子排布相同,质子数越多半径越小,简单离子的半径大小为:F->Al3+ ,答案为F->Al3+ ; (4)元素非金属性强弱比较方法有:A.比较两种单质的颜色,a错误;B.比较两种单质与H2化合的难易程度,与H2化合越容易,非金属性越强,b正确;C.依据两元素在周期表中的位置,F和Cl同主族,非金属性逐渐减弱,c正确;D.比较对应阴离子的还原性,对应阴离子的还原性越强,单质的氧化性越弱,非金属性越弱,d正确;e.比较最高价氧化物对应水化物的酸性,最高价氧化物对应水化物的酸性越强,非金属性越强,但是F元素没有负化合价,没有最高价氧化的水化物,e错误,不可行的是a、e,答案为:(4)a、e ;(5) E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比1∶4,相对分子质量为154,该化合物是CCl4,答案为:CCl4

【题目】(1).HNO3与金属反应情况多种多样.为探究HNO3性质,某兴趣小组作如下探究:用浓硝酸和水按照不同体积比配成不同浓度的硝酸溶液,各取10mL硝酸溶液分别与铜片反应,实验记录如下:
序号 | 浓硝酸与水的体积比 | 实 验 现 象 |
Ⅰ | 1 ﹕1 | 反应速率快,溶液很快变成蓝色,铜丝表面有大量气泡冒出,气体呈红棕色 |
Ⅱ | 1 ﹕3 | 反应速率较快,溶液变成蓝色,铜丝表面有大量气泡冒出,气体无色 |
Ⅲ | 1 ﹕5 | 反应速率慢,微热后速率加快,溶液变成蓝色,铜丝表面有气泡冒出,气体无色 |
制备NO气体最适宜的是: ,理由是: .
(2).兴趣小组以木炭和浓硝酸为起始原料,探究一氧化氮与过氧化钠反应制备亚硝酸钠。设计装置如下(忽略装置中空气的影响),请回答下列问题:
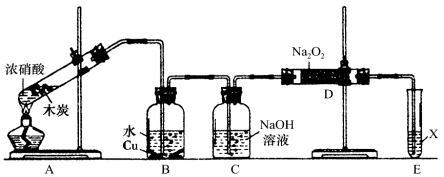
①组装好仪器后,必须进行的一项操作是:_________________。
②推测B中可以观察到的主要现象是:______;C装置的作用是: 。
③装置D中除生成NaNO2外,还有另一种固态物质Y,Y的化学式是:_____。可以通过适当改进,不产生Y物质,请你提出改进方法: _。
④E装置的实验目的是: 。