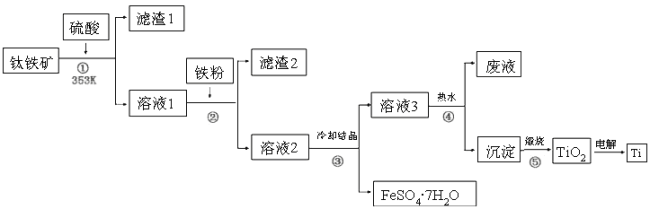
题目内容
【题目】(1)实验室用电石和水反应制取乙炔
①反应的化学方程式为__________。
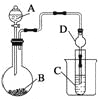
②下图是反应装置,其中正确的是__________。

③为了减缓反应速率,通常用__________代替水,该反应是__________反应(“放热”或者“吸热”)
④该反应产生的气体,含有杂质H2S,可用硫酸铜溶液吸收,反应的离子方程式为__________。
(2)实验室通常用浓硫酸和乙醇混合加热制取乙烯
①混合浓硫酸和乙醇的操作方法是__________。
②该实验中制取装置所用的玻璃仪器有酒精灯、导管、__________和__________;
③反应生成的乙烯中,含有多种CO2、CO2、水等多种杂质,写出浓硫酸直接将乙醇氧化生成CO2的化学方程式__________。
【答案】(1)①CaC2+2H2O→Ca(OH)2+C2H2↑;②C;③饱和NaCl溶液;放热;④H2S+Cu2+==CuS↓+2H+
(2)①将浓硫酸沿玻璃杯慢慢注入酒精中,边加边搅拌;②温度计;烧瓶;③C2H5OH+6H2SO4(浓)→2CO2↑+6CO2↑+9H2O
【解析】
试题分析:(1)①实验室用电石和水反应制取乙炔的化学方程式为CaC2+2H2O→Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
②电石和水反应制取乙炔是一个放热反应,不能用启普发生器,反应无需加热,为了便于控制加入水的速度,应该选用分液漏斗滴加,故选C。
③为了减缓反应速率,通常用饱和NaCl溶液代替水,该反应是放热反应,故答案为:饱和NaCl溶液;放热;
④该反应产生的气体,含有杂质H2S,可用硫酸铜溶液吸收,反应的离子方程式为H2S+Cu2+==CuS↓+2H+,故答案为:H2S+Cu2+==CuS↓+2H+;
(2)①实验室通常用浓硫酸和乙醇混合加热制取乙烯,混合浓硫酸和乙醇的操作方法是将浓硫酸沿玻璃杯慢慢注入酒精中,边加边搅拌,故答案为:将浓硫酸沿玻璃杯慢慢注入酒精中,边加边搅拌;
②该实验中制取装置所用的玻璃仪器有酒精灯、导管、温度计和烧瓶,故答案为:温度计;烧瓶;
③浓硫酸直接将乙醇氧化生成CO2的化学方程式为C2H5OH+6H2SO4(浓)→2CO2↑+6CO2↑+9H2O,故答案为:C2H5OH+6H2SO4(浓)→2CO2↑+6CO2↑+9H2O。

【题目】短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如表:
元素编号 | 元 素 特 征 信 息 |
A | 最外层电子数是次外层电子数的2倍 |
B | 和E同主族 |
C | 1 mol C单质能与冷水反应,在标准状况下生成11.2 L H2 |
D | 原子最外层电子数等于其周期序数 |
E | 负一价阴离子的电子层结构与Ar原子相同 |
(1)D原子结构示意图为: _____ __ ,E在周期表中的位置为: 。
(2)B和C形成的化合物的电子式为: 。
(3)B和D简单离子的半径大小为: 。
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是: (填序号)。
A.比较两种单质的颜色 B.比较两种单质与H2化合的难易程度
C.依据两元素在周期表中的位置 D.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比1∶4,相对分子质量为154,则该物质的化学式为: 。