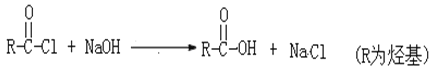
题目内容
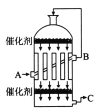
【题目】实验室制取少量溴乙烷的装置如图所示。根据题意完成下列填空:
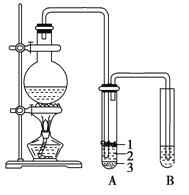
(1)圆底烧瓶中加入的反应物是溴化钠、______________、和1∶1的硫酸。配制体积比1∶1的硫酸所用的定量仪器为______________(选填编号)。
a.天平 b.量筒 c.容量瓶 d.碱式滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式________________________________________________,________________________________________________。
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是________________________________________________________________________。
试管A中的物质分为三层(如图所示),产物在第________________层(填序号)。
(4)试管A中除了产物和水之外,还可能存在___________、___________(写出化学式)。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是___________(选填编号)。
a.蒸馏 b.用氢氧化钠溶液洗涤 c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是______________。
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是________________________________________________________________________。
【答案】(1)乙醇 b(2)NaBr+H2SO4===HBr+NaHSO4 ; CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
(3)冷却、液封溴乙烷 3 (4)HBr CH3CH2OH(合理即可)
(5)d 乙烯(6)反应会产生Br2,腐蚀橡胶
【解析】
试题分析:(1)此实验需要加入溴化钠,乙醇和浓硫酸,量取溶液的体积要求精确度不是很高,可用量筒量取,故答案为b;(2)药品混合后在加热条件下生成HBr并和乙醇发生取代反应,反应的化学方程式为:NaBr+H2SO4═HBr+NaHSO4、HBr+CH3CH2OH ![]() CH3CH2Br+H2O;(3)收集装置所用导气管较长,可以起到冷却的作用,生成的溴乙烷和水互不相溶,并且溴乙烷的密度比水大,在冰水混合物的下层,故答案为冷却、液封溴乙烷;3;(4)在加热条件下反应,HBr和CH3CH2OH都易挥发,故生成物中有存在HBr、CH3CH2OH,故答案为HBr;CH3CH2OH;(5)试管A中获得的有机物呈棕黄色,是由于浓硫酸具有强氧化性,将HBr氧化物Br2,产物为溴乙烷,混有单质溴,蒸馏不能完全除去杂质,并且操作麻烦,氢氧化钠溶液易使溴乙烷水解,四氯化碳会引入新的杂质,而亚硫酸钠和溴发生氧化还原反应生成HBr和硫酸钠,易与溴乙烷分离,所以d正确。 (6)反应会产生Br2,腐蚀橡胶,因此装置中的仪器连接部分都改成标准玻璃接口。
CH3CH2Br+H2O;(3)收集装置所用导气管较长,可以起到冷却的作用,生成的溴乙烷和水互不相溶,并且溴乙烷的密度比水大,在冰水混合物的下层,故答案为冷却、液封溴乙烷;3;(4)在加热条件下反应,HBr和CH3CH2OH都易挥发,故生成物中有存在HBr、CH3CH2OH,故答案为HBr;CH3CH2OH;(5)试管A中获得的有机物呈棕黄色,是由于浓硫酸具有强氧化性,将HBr氧化物Br2,产物为溴乙烷,混有单质溴,蒸馏不能完全除去杂质,并且操作麻烦,氢氧化钠溶液易使溴乙烷水解,四氯化碳会引入新的杂质,而亚硫酸钠和溴发生氧化还原反应生成HBr和硫酸钠,易与溴乙烷分离,所以d正确。 (6)反应会产生Br2,腐蚀橡胶,因此装置中的仪器连接部分都改成标准玻璃接口。

【题目】短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如表:
元素编号 | 元 素 特 征 信 息 |
A | 最外层电子数是次外层电子数的2倍 |
B | 和E同主族 |
C | 1 mol C单质能与冷水反应,在标准状况下生成11.2 L H2 |
D | 原子最外层电子数等于其周期序数 |
E | 负一价阴离子的电子层结构与Ar原子相同 |
(1)D原子结构示意图为: _____ __ ,E在周期表中的位置为: 。
(2)B和C形成的化合物的电子式为: 。
(3)B和D简单离子的半径大小为: 。
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是: (填序号)。
A.比较两种单质的颜色 B.比较两种单质与H2化合的难易程度
C.依据两元素在周期表中的位置 D.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比1∶4,相对分子质量为154,则该物质的化学式为: 。