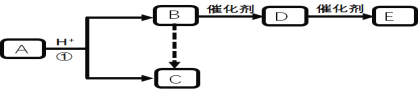
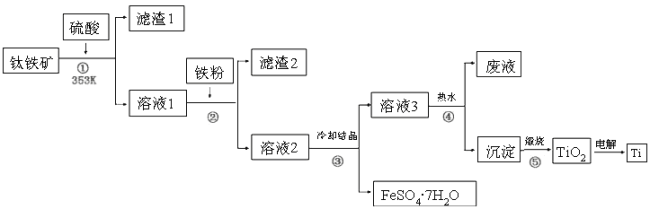
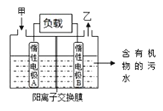
题目内容
【题目】在一定温度下的某容积可变的密闭容器中进行反应:C(s)+H2O(g)![]() CO(g)+H2(g)。下列说法或结论不成立的是
CO(g)+H2(g)。下列说法或结论不成立的是
A.当体系的体积不再发生变化,该反应已建立平衡
B.达到平衡后向体系中充入少量He,平衡不移动
C.增大水蒸气的用量可以提高碳粉的转化率
D.若断裂1 molH-H键的同时断裂2molH-O键,则反应达到平衡
【答案】B
【解析】
试题分析:A、因为反应为前后气体物质的量改变的反应,所以当容器的体积不变时,说明反应已经到平衡,故A正确;B、到平衡后,冲入少量的氦气,容器的体积增大,相当于检验,平衡正向移动,故B错误;C、增大水蒸气的量,平衡正向移动,提高碳的转化率,故C正确;D、断裂1摩尔氢氢键,说明有1摩尔氢气反应,断裂2摩尔氢氧键,说明有1摩尔水反应,正反应速率和逆反应速率相等,反应到平衡,故D正确。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如表:
元素编号 | 元 素 特 征 信 息 |
A | 最外层电子数是次外层电子数的2倍 |
B | 和E同主族 |
C | 1 mol C单质能与冷水反应,在标准状况下生成11.2 L H2 |
D | 原子最外层电子数等于其周期序数 |
E | 负一价阴离子的电子层结构与Ar原子相同 |
(1)D原子结构示意图为: _____ __ ,E在周期表中的位置为: 。
(2)B和C形成的化合物的电子式为: 。
(3)B和D简单离子的半径大小为: 。
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是: (填序号)。
A.比较两种单质的颜色 B.比较两种单质与H2化合的难易程度
C.依据两元素在周期表中的位置 D.比较对应阴离子的还原性
e.比较最高价氧化物对应水化物的酸性
(5)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比1∶4,相对分子质量为154,则该物质的化学式为: 。