题目内容
2. 某反应:2A(g)?B(g)+C(g),在甲、乙两个容积都是1L,且不变的容器中进行,开始时在两个容器中均放入0.5mol A,甲容器中3s后B的物质的量浓度达到0.18mol/L且保持不变,乙容器中2s时B的物质的量浓度即达到0.18mol/L,且保持不变,则( )
某反应:2A(g)?B(g)+C(g),在甲、乙两个容积都是1L,且不变的容器中进行,开始时在两个容器中均放入0.5mol A,甲容器中3s后B的物质的量浓度达到0.18mol/L且保持不变,乙容器中2s时B的物质的量浓度即达到0.18mol/L,且保持不变,则( )| A. | 乙容器中使用了比甲容器更高的温度 | |
| B. | 乙容器中加入了某种不与体系反应的气体,增大了容器内的压强 | |
| C. | 乙容器中使用了催化剂 | |
| D. | 乙容器中可能既升高了温度又使用了催化剂 |
分析 根据在甲、乙两个容积都是1L,且不变的容器中进行,开始时在两个容器中均放入0.5mol A,甲容器中3s后B的物质的量浓度达到0.18mol/L且保持不变,乙容器中2s时B的物质的量浓度即达到0.18mol/L,且保持不变,说明甲乙平衡状态相同,只是乙的速率比甲快,结合2A(g)?B(g)+C(g)为气体体积不变的反应分析.
解答 解:根据在甲、乙两个容积都是1L,且不变的容器中进行,开始时在两个容器中均放入0.5mol A,甲容器中3s后B的物质的量浓度达到0.18mol/L且保持不变,乙容器中2s时B的物质的量浓度即达到0.18mol/L,且保持不变,说明甲乙平衡状态相同,只是乙的速率比甲快,又2A(g)?B(g)+C(g)为气体体积不变的反应,所以乙可能为压缩体积增大压强或者使用催化剂,故C正确;
故选:C.
点评 本题考查化学平衡速率及其移动原理,难度中等,催化剂仅加快反应速率不改变平衡移动是解题关键.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
17.常温下,在水溶液中能大量共存的一组离子是( )
| A. | Fe2+、Al3+、ClO-、Cl- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:Ca2+、Na+、ClO-、NO3- | |
| C. | NH4+、Na+、Br-、SO42- | |
| D. | Mg2+、H+、SiO32-、SO42- |
7.下列实验操作中错误的是( )
| A. | 蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 过滤操作时,向过滤器中倾倒液体时一定要用玻璃棒引流 | |
| D. | 由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 |
14.我国“十二五”期间地球日主题宣传活动的主题为“珍惜地球资源,转变发展方式”.下列行为不符合活动主题的是( )
| A. | 更新采煤、采油技术,提高产量以满足工业生产快速发展的需要 | |
| B. | 控制含磷洗涤剂的使用,防止水体富营养化,保护水资源 | |
| C. | 开发太阳能、水能、风能、可燃冰等新能源,减少使用煤、石油等化石燃料 | |
| D. | 落实资源的“3R”发展观,即减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle) |
11.下列说法正确的是( )
| A. | NH3的水溶液能导电,所以NH3是电解质 | |
| B. | BaSO4其水溶液几乎不导电,但BaSO4是电解质 | |
| C. | 液溴不导电,所以液溴是非电解质 | |
| D. | 食盐水能导电,故其属于电解质 |


 .E的周期表中的位置:第三周期第ⅥA族.
.E的周期表中的位置:第三周期第ⅥA族.
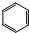 +3H2$→_{高温高压}^{催化剂}$
+3H2$→_{高温高压}^{催化剂}$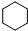 ;加成反应
;加成反应 ;取代反应.
;取代反应.