题目内容
17.常温下,在水溶液中能大量共存的一组离子是( )| A. | Fe2+、Al3+、ClO-、Cl- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:Ca2+、Na+、ClO-、NO3- | |
| C. | NH4+、Na+、Br-、SO42- | |
| D. | Mg2+、H+、SiO32-、SO42- |
分析 A.次氯酸根离子能够氧化亚铁离子,铝离子与次氯酸根离子发生双水解反应;
B.该溶液为酸性溶液,溶液中存在大量氢离子,次氯酸根离子与氢离子反应;
C.四种离子之间不反应,能够大量共存;
D.镁离子、氢离子与硅酸根离子反应.
解答 解:A.Fe2+、ClO-之间发生双水解反应,Fe2+、ClO-之间发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.该溶液中存在大量氢离子,ClO-与氢离子反应生成次氯酸,在溶液中不能大量共存,故B错误;
C.NH4+、Na+、Br-、SO42-之间不发生反应,在溶液中能够大量共存,故C正确;
D.Mg2+、H+与SiO32发生反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的正误判断,题目难度中等,注意掌握离子反应发生条件,明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8. 原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素.元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D+比F-少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的甲、乙两种分子,且两种分子中各原子的个数见下表:
原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素.元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D+比F-少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的甲、乙两种分子,且两种分子中各原子的个数见下表:
(1)元素F的基态原子的电子排布式为1s22s22p63s23p5.
(2)分子甲的空间构型为正四面体,该分子中B的原子轨道发生的是sp3杂化.
(3)E单质属于分子晶体,E与A元素形成极性分子(填“极性”或“非极性”)
(4)D在F中燃烧的产物属于离子晶体,其晶体中与D+最近且等距离的F-有6个.
(5)C元素的第一电离能(I1)>氧元素的第一电离能(I1)(填“<”或“>”或“=”).
 原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素.元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D+比F-少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的甲、乙两种分子,且两种分子中各原子的个数见下表:
原子序数依次增大A、B、C、D、E、F(A、B、C、D、E、F分别代表元素符号)六种短周期元素.元素A的原子半径在短周期中最小,元素C的单质在空气中含量最多,D+比F-少一个电子层,E所在周期的各元素单质沸点变化如下图(元素按原子序数递增顺序连续排列),B、C两种元素分别能与A形成等电子的甲、乙两种分子,且两种分子中各原子的个数见下表:| 化合物 | 甲 | 乙 |
| 原子个数比 | B:A=1:4 | C:A=1:3 |
(2)分子甲的空间构型为正四面体,该分子中B的原子轨道发生的是sp3杂化.
(3)E单质属于分子晶体,E与A元素形成极性分子(填“极性”或“非极性”)
(4)D在F中燃烧的产物属于离子晶体,其晶体中与D+最近且等距离的F-有6个.
(5)C元素的第一电离能(I1)>氧元素的第一电离能(I1)(填“<”或“>”或“=”).
5.下列有关能量转换的说法正确的是( )
| A. | 风力发电是化学能转换为电能 | |
| B. | 植物燃烧时放出的能量来源于太阳能 | |
| C. | 动物体内的葡萄糖被氧化成CO2,是热能转换成化学能 | |
| D. | 植物通过光合作用将CO2转化为葡萄糖,是将太阳能转换成热能 |
12.如图图是实验室制取乙烯的发生、净化和用排水法测量生成C2H4体积的实验装置图:图中A、B、C、D、E、F的虚线部分是玻璃导管接口,接口的弯曲和伸长部分未画出.根据要求填写下列各小题空白.

(1)若所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号):③接①接②接④.其中①与②装置相连时,玻璃导管连接(用装置中字母表示)应是B接D.
(2)若加热时间过长,温度过高生成的乙烯中常混有SO2,为除去SO2,装置①中应盛的试剂是氢氧化钠溶液.
(3)装置③中碎瓷片的作用是防止暴沸,浓H2SO4的作用是脱水剂和催化剂,此装置中发生的主要反应的化学方程式是CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(4)实验开始时首先应检查装置的气密性,实验结束时,应先拆去A处(用装置中字母表示)的玻璃导管,再熄灭③处的酒精灯.
(5)实验结束时若装置④中水的体积在标况下为0.112L,则实验中至少消耗乙醇0.005mol.
| 装置序号 | ① | ② | ③ | ④ |
| 各仪器装置图 | 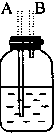 | 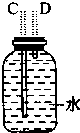 | 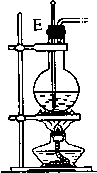 |  |

(1)若所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号):③接①接②接④.其中①与②装置相连时,玻璃导管连接(用装置中字母表示)应是B接D.
(2)若加热时间过长,温度过高生成的乙烯中常混有SO2,为除去SO2,装置①中应盛的试剂是氢氧化钠溶液.
(3)装置③中碎瓷片的作用是防止暴沸,浓H2SO4的作用是脱水剂和催化剂,此装置中发生的主要反应的化学方程式是CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(4)实验开始时首先应检查装置的气密性,实验结束时,应先拆去A处(用装置中字母表示)的玻璃导管,再熄灭③处的酒精灯.
(5)实验结束时若装置④中水的体积在标况下为0.112L,则实验中至少消耗乙醇0.005mol.
2. 某反应:2A(g)?B(g)+C(g),在甲、乙两个容积都是1L,且不变的容器中进行,开始时在两个容器中均放入0.5mol A,甲容器中3s后B的物质的量浓度达到0.18mol/L且保持不变,乙容器中2s时B的物质的量浓度即达到0.18mol/L,且保持不变,则( )
某反应:2A(g)?B(g)+C(g),在甲、乙两个容积都是1L,且不变的容器中进行,开始时在两个容器中均放入0.5mol A,甲容器中3s后B的物质的量浓度达到0.18mol/L且保持不变,乙容器中2s时B的物质的量浓度即达到0.18mol/L,且保持不变,则( )
 某反应:2A(g)?B(g)+C(g),在甲、乙两个容积都是1L,且不变的容器中进行,开始时在两个容器中均放入0.5mol A,甲容器中3s后B的物质的量浓度达到0.18mol/L且保持不变,乙容器中2s时B的物质的量浓度即达到0.18mol/L,且保持不变,则( )
某反应:2A(g)?B(g)+C(g),在甲、乙两个容积都是1L,且不变的容器中进行,开始时在两个容器中均放入0.5mol A,甲容器中3s后B的物质的量浓度达到0.18mol/L且保持不变,乙容器中2s时B的物质的量浓度即达到0.18mol/L,且保持不变,则( )| A. | 乙容器中使用了比甲容器更高的温度 | |
| B. | 乙容器中加入了某种不与体系反应的气体,增大了容器内的压强 | |
| C. | 乙容器中使用了催化剂 | |
| D. | 乙容器中可能既升高了温度又使用了催化剂 |
9.下列除杂方法正确的是( )
| A. | SiO2中含Al2O3杂质,可以加入足量NaOH溶液然后过滤除去 | |
| B. | NH4Cl固体中混有少量的单质I2,可用加热方法将I2除去 | |
| C. | CO2中含有SO2杂质,可以通过盛有饱和Na2CO3溶液的洗气瓶除去 | |
| D. | NaHCO3溶液中含有Na2SiO3杂质,可以通入足量的CO2,然后过滤除去 |
 在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应:
在450℃并有催化剂存在下,于一容积恒定的密闭容器内进行下列反应: