题目内容
10.1L混合溶液中含SO42- 0.00025mol,Cl-0.0005mol,NO3- 0.00025mol,Na+ 0.00025mol,其余为H+,则H+物质的量浓度为( )| A. | 0.0025 mol•L-1 | B. | 0.0001mol•L-1 | C. | 0.001mol•L-1 | D. | 0.005mol•L-1 |
分析 混合液中一定满足电荷守恒,即:溶液中的阳离子带电的电荷量与阴离子所带电电荷量相等,据此结合题中数据列式计算.
解答 解:因溶液中的离子有Na+、Cl-、NO3-、SO42、H+,设H+物质的量浓度为c,
溶液不显电性,溶液中的阳离子带电的总电荷量与阴离子所带电的总电荷量相等,
则:0.00025mol×2+0.0005mol×1+0.00025mol×1=0.00025mol×1+c×1L,
解得:c=0.001mol/L,
故选C.
点评 本题考查了物质的量浓度的计算,题目难度中等,注意掌握物质的量浓度的概念及计算方法,明确电荷守恒为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
20.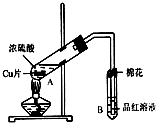 某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
(1)写出试管B中的实验现象品红溶液褪色.
(2)写出A中反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(3)B试管口的棉花应沾有的试剂是NaOH.
(4)反应后有铜剩余,若不补充浓硫酸,要使铜片溶解,继续向A试管中加入H2O2,发现铜片又溶解,反应的离子方程式为:Cu+H2O2+2H+=Cu2++2H2O.或者可以加Fe2O3、NaNO3(填写两种属于不同类别物质的化学式),也能使铜片溶解.
(5)小组成员向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4•xH2O).小组成员采用加热法测定该晶体里结晶水x的值.
下面是其中一次实验的数据:
根据上表数据计算判断x的实侧值比理论值(x=5)偏小(填“偏大”、“偏小”),这次实验中产生误差的原因可能是AD(填序号)
A.硫酸铜晶体中含有不挥发的杂质 B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却.
 某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.(1)写出试管B中的实验现象品红溶液褪色.
(2)写出A中反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(3)B试管口的棉花应沾有的试剂是NaOH.
(4)反应后有铜剩余,若不补充浓硫酸,要使铜片溶解,继续向A试管中加入H2O2,发现铜片又溶解,反应的离子方程式为:Cu+H2O2+2H+=Cu2++2H2O.或者可以加Fe2O3、NaNO3(填写两种属于不同类别物质的化学式),也能使铜片溶解.
(5)小组成员向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4•xH2O).小组成员采用加热法测定该晶体里结晶水x的值.
下面是其中一次实验的数据:
| 坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.9g |
A.硫酸铜晶体中含有不挥发的杂质 B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却.
1.下列离子方程式正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 次氯酸钠溶液与醋酸溶液混合:ClO-+H+═HClO | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+ $\frac{\underline{\;\;△\;\;}}{\;}$ Fe3++3NO2↑+3H2O |
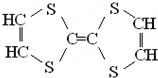
18.有机物结构如图所示,下列说法中不正确的是( )


| A. | 与稀H2SO4共热,生成2种有机物 | |
| B. | 该有机物的分子式为C14H10O9 | |
| C. | 常温下,能与NaHCO3溶液反应放出CO2 | |
| D. | 能发生碱性水解反应,1mol该有机物完全反应消耗掉8molNaOH |
12.下列有关说法不正确的是( )
| A. | 互为同系物的有机物其组成元素相同,且结构必须相似 | |
| B. | 分子组成相差一个或若干个CH2原子团的化合物一定互为同系物 | |
| C. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 | |
| D. | 互为同系物的有机物其相对分子质量数值一定相差14 n(n为正整数) |
 ,X分子的空间构型为三角锥形.
,X分子的空间构型为三角锥形.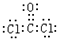 .
.
 D在周期表的位置:第三周期VIIA族.
D在周期表的位置:第三周期VIIA族.