题目内容
5.有A、B、C、D、E五种短周期的主族元素,它们的原子序数依次增大.B元素的最高正价与最低负价的绝对值之差为2,C元素原子最外层电子数是次外层电子数的3倍,D元素在所在周期中原子半径最大:A与B、C分别构成电子数相等的化合物X、Y,A与E形成化合物W,W在空气中产生白雾,(1)画出E的原子结构示意图
 ,X分子的空间构型为三角锥形.
,X分子的空间构型为三角锥形.(2)五种元素原子半径由大到小的顺序是(用元素符号表示)Na、Cl、N、O、H,C和D形成的化合物属于离子晶体(填晶体类型).
(3)在同主族氢化物的性质中,Y的沸点反常,原因是水分子之间形成氢键.
(4)写出X催化氧化的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(5)Z是由3种元素构成的分子,Z与X按物质的量1:2反应生成尿素[CO(NH2)2]和化合物W.则化合物Z的电子式为
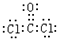 .
.
分析 A、B、C、D、E五种短周期的主族元素,它们的原子序数依次增大.C元素原子最外层电子数是次外层电子数的3倍,则C原子有2个电子层,最外层电子数为6,则C为氧元素;D元素在所在周期中原子半径最大,原子序数大于氧元素,应处于第三周期,则D为Na元素;B元素的最高正价与最低负价的绝对值之差为2,处于ⅤA族,其原子序数小于氧元素,故B为氮元素;A与B、C分别构成电子数相等的化合物X、Y,则A为H元素、X为NH3、Y为H2O;A与E形成化合物W,W在空气中产生白雾,则E为Cl元素、W为HCl,据此进行解答.
解答 解:A、B、C、D、E五种短周期的主族元素,它们的原子序数依次增大.C元素原子最外层电子数是次外层电子数的3倍,则C原子有2个电子层,最外层电子数为6,则C为氧元素;D元素在所在周期中原子半径最大,原子序数大于氧元素,应处于第三周期,则D为Na元素;B元素的最高正价与最低负价的绝对值之差为2,处于ⅤA族,其原子序数小于氧元素,故B为氮元素;A与B、C分别构成电子数相等的化合物X、Y,则A为H元素、X为NH3、Y为H2O;A与E形成化合物W,W在空气中产生白雾,则E为Cl元素、W为HCl,
(1)E为Cl元素,原子序数为17,其原子结构示意图为: ,X为NH3,其空间构型为三角锥形,
,X为NH3,其空间构型为三角锥形,
故答案为: ;三角锥形;
;三角锥形;
(2)电子层越多,原子半径越大,电子层相同时,核电荷数越大,原子半径越小,则五种元素的原子半径大小顺序为:Na、Cl、N、O、H;
C、D分别为O和Na元素,二者形成的氧化钠和过氧化钠都属于离子化合物,形成的晶体为离子晶体,
故答案为:Na、Cl、N、O、H;离子;
(3)水分子之间形成氢键,分子之间的作用力增强,其沸点高于同主族其它元素氢化物,
故答案为:水分子之间形成氢键;
(4)X为氨气,NH3催化氧化生成一氧化氮和水,反应的化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(5)Z是由3种元素构成的分子,能与NH3以1:2的物质的量之比反应生成尿素CO(NH2)2和HCl,则Z含有C、O、Cl三种元素,结合质量守恒可知Z应为COCl2,其电子式为: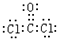 ,
,
故答案为: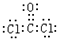 .
.
点评 本题考查结构、性质、位置关系运用,题目难度中等,涉及常用化学用语的书写、元素化合物性质等知识,推断元素是解题关键,(5)中注意利用质量守恒定律确定Z的组成.

| A. | 4℃时40ml水 | B. | 0.8mol硫酸 | ||
| C. | 9.03×1022个氧分子 | D. | 54g铝 |
| A. | 工业上通过电解氯化钠溶液制取金属钠 | |
| B. | 金属镁在空气燃烧后的产物除MgO外,还有Mg3N2和C等 | |
| C. | 钠钾合金可在快中子反应堆中作热交换剂 | |
| D. | 钠可用于从钛、铌等金属的氯化物中置换出金属单质 |
| A. | 0.0025 mol•L-1 | B. | 0.0001mol•L-1 | C. | 0.001mol•L-1 | D. | 0.005mol•L-1 |
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
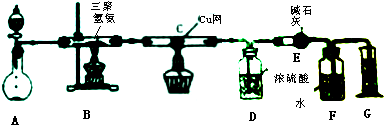
查阅资料,三聚氰胺的相对分子质量为126,三聚氰胺在常温下成晶体,在加热条件下能与氧气发生反应生成二氧化碳、氮气和水.取12.6g的三聚氰胺晶体如图装置进行实验(假设三聚氰胺完全反应转化产物).
(1)抑制A装置中固体为Na2O2,请写出其中发生反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑;
(2)D装置不能与E装置互换的理由是浓硫酸吸水,碱石灰吸收二氧化碳,若互换位置,则碱石灰会同时吸收水和二氧化碳,导致实验失败;
(3)当B装置中反应完全发生后,读取G中的体积的使用操作顺序为②③①(填序号).
①读数②冷却至室温③调平F、G装置中的液面
(4)测定数据如下:
| 装置 | D | E |
| 实验前 | 101.0g | 56.0g |
| 实验后 | 106.4g | 69.2g |
①利用上述实验数据,计算三聚氰胺的量筒式为CN2H2;
②三聚氰胺的分子式为C3N6H6;
③若没有C装置中的铜网,对测定结果的影响是测定所得分子式的氮原子数偏大,而碳、氢原子数偏小.
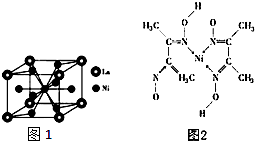 镍(Ni)是一种重要的金属,金属镍及其化合物在合金材料以及催化剂等方面应用广泛.
镍(Ni)是一种重要的金属,金属镍及其化合物在合金材料以及催化剂等方面应用广泛. 、④HCHO其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形;
、④HCHO其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形;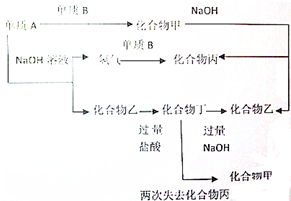 下列各单质和化合物之间有以下的转化关系,而且各单质和化合物的组成元素的原子序数均小于18,据图所示的关系判断:
下列各单质和化合物之间有以下的转化关系,而且各单质和化合物的组成元素的原子序数均小于18,据图所示的关系判断: