题目内容
2.同温同压下,等体积的CO和C2H4(乙烯、气体)分别在足量的氧气中完全燃烧,消耗氧气的体积比为1:6.分析 发生反应:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2、C2H4+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2H2O,令CO和C2H4的体积均为2L,根据方程式计算消耗氧气的体积.
解答 解:令CO和C2H4的体积均为2L,则:
2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2
2 1
2L 1L
C2H4+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+2H2O
1 3
2L 6L
故同温同压下,等体积的CO和C2H4(乙烯、气体)分别在足量的氧气中完全燃烧,消耗氧气的体积比为1L:6L=1:6,
故答案为:1:6.
点评 本题考查化学方程式有关计算,明确发生的反应即可解答,侧重对基础知识的巩固.

练习册系列答案
相关题目
10.1L混合溶液中含SO42- 0.00025mol,Cl-0.0005mol,NO3- 0.00025mol,Na+ 0.00025mol,其余为H+,则H+物质的量浓度为( )
| A. | 0.0025 mol•L-1 | B. | 0.0001mol•L-1 | C. | 0.001mol•L-1 | D. | 0.005mol•L-1 |
6.分子式为C4H8烯烃的同分异构体(包括顺反异构)有( )种.
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
3.卤族元素及其化合物与社会、生活关系密切.下列有关说法错误的是( )
| A. | 加碘食盐中加入的是KIO3 | |
| B. | 常用于杀菌消毒的84消毒液的主要成份是NaClO | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 变色眼镜和照相器材的生产都可能要用到溴化银 |
4.下列表示正确的是( )
| A. | 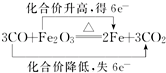 | B. |  | ||
| C. | 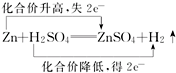 | D. | 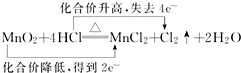 |
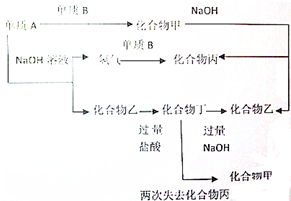 下列各单质和化合物之间有以下的转化关系,而且各单质和化合物的组成元素的原子序数均小于18,据图所示的关系判断:
下列各单质和化合物之间有以下的转化关系,而且各单质和化合物的组成元素的原子序数均小于18,据图所示的关系判断: