题目内容
18.物质的类别和核心元素的化合价是研究物质性质的两个基本视角.(1)X的电子式是
 .
.(2)Na2S2O3是一种用途广泛的钠盐.从理论上分析,下列物质组合中能用于制备Na2S2O3的是b(填字母序号).
a.Na2S+S b.Z+S c.Na2SO3+Y
(3)硒(34Se)和S位于同一主族.
①H2Se的稳定性比H2S的(填“强”或“弱”)弱,断开1mol H-Se键吸收的能量比断开1mol H-S键吸收的能量(填“多”或“少”)少.用原子结构解释原因:同主族元素最外层电子数相同,从上到下电子层数增加,原子半径增大,原子核对最外层电子的吸引力减弱,元素的非金属性减弱.
②写出SeO2与NaOH溶液反应的离子方程式:SeO2+2OH-=SeO32-+H2O.

分析 (1)X为H2S,S最外层6个电子,能够与2个H原子形成共价键;
(2)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2;
(3)①同主族非金属氢化物稳定性减弱,原子半径增大H-Se键的键能小于H-S键的键能;
②依据二氧化硒是酸性氧化物和碱反应生成盐和水.
解答 解:(1)X为H2S,S最外层6个电子,能够与2个H原子形成共价键,其电子式为: ,故答案为:
,故答案为: ;
;
(2)Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2,a中S化合价都小于2,c中S的化合价都大于2,b符合题意,
故答案为:b;
(3)①同主族非金属氢化物稳定性减弱,原子半径增大H-Se键的键能小于H-S键的键能断开1mol H-Se键吸收的能量比断开1mol H-S键吸收的能量少,用原子结构解释原因:同主族元素最外层电子数相同,从上到下电子层数增加,原子半径增大,原子核对最外层电子的吸引力减弱,元素的非金属性减弱,
故答案为:弱;少;电子层数增加,原子半径增大,原子核对最外层电子的吸引力减弱,元素的非金属性减弱;
②二氧化硒是酸性氧化物和碱反应生成盐和水,反应的离子方程式为:SeO2+2OH-=SeO32-+H2O,
故答案为:SeO2+2OH-=SeO32-+H2O.
点评 本题考查了核外电子的排布与电子式、氧化还原反应,周期表中通主族递变规律的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
8.${\;}_{53}^{131}$I是碘的一种核素,其中子数为( )
| A. | 25 | B. | 53 | C. | 78 | D. | 131 |
9.下列用水就能鉴别的一组物质是( )
| A. | 己烷、四氯化碳 | B. | 汽油、己烷 | ||
| C. | 乙醇、乙酸 | D. | 1,2-二溴乙烷、四氯化碳 |
6.下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
①Al ②Al2O3③AlCl3 ④Al(OH)3.
①Al ②Al2O3③AlCl3 ④Al(OH)3.
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②④ |
13.下列物质中,属于共价化合物的是( )
| A. | O3 | B. | PCl3 | C. | Na2O2 | D. | NH4Cl |
10.下列说法正确的是( )
| A. | 0.01mol/L的盐酸与0.01 mol/L的NaOH溶液等体积混合后,溶液呈中性 | |
| B. | 0.01mol/L的醋酸与0.01 mol/L的NaOH溶液等体积混合后,溶液呈酸性 | |
| C. | pH=2的盐酸与pH=12的氨水溶液等体积混合后,溶液呈碱性 | |
| D. | pH=2的醋酸与pH=12的NaOH溶液等体积混合后,溶液呈碱性 |
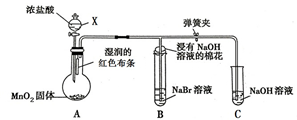 如图是一个制取氯气并验证氯气某些性质的装置.(夹持和加热装置省略)
如图是一个制取氯气并验证氯气某些性质的装置.(夹持和加热装置省略)