题目内容
10.下列说法正确的是( )| A. | 0.01mol/L的盐酸与0.01 mol/L的NaOH溶液等体积混合后,溶液呈中性 | |
| B. | 0.01mol/L的醋酸与0.01 mol/L的NaOH溶液等体积混合后,溶液呈酸性 | |
| C. | pH=2的盐酸与pH=12的氨水溶液等体积混合后,溶液呈碱性 | |
| D. | pH=2的醋酸与pH=12的NaOH溶液等体积混合后,溶液呈碱性 |
分析 A.HCl和强氧化钠都是强电解质,等体积的二者混合恰好反应生成氯化钠和水,溶液呈中性;
B.二者反应生成醋酸钠,醋酸钠为强碱弱酸盐,溶液呈碱性;
C.一水合氨为弱碱,混合液中氨水过量,溶液呈碱性;
D.醋酸为弱酸,混合液中醋酸过量,溶液呈酸性.
解答 解:A.0.01mol/L的盐酸与0.01 mol/L的NaOH溶液等体积混合,反应后溶质为强酸强碱盐氯化钠,溶液呈中性,故A正确;
B.0.01mol/L的醋酸与0.01 mol/L的NaOH溶液等体积混合,反应后溶质为醋酸钠,醋酸根离子部分水解,导致溶液呈碱性,故B错误;
C.pH=2的盐酸与pH=12的氨水溶液等体积混合后,一水合氨为弱碱,则混合液中氨水过量,溶液呈碱性,故C正确;
D.pH=2的醋酸与pH=12的NaOH溶液等体积混合后,醋酸在溶液中部分电离,则混合液中醋酸过量,溶液呈酸性,故D错误;
故选AC.
点评 本题考查了酸碱混合的定性判断,题目难度中等,明确反应后溶质组成及弱电解质的电离平衡为解答关键,注意掌握酸碱混合的定性判断方法,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
20.我国报道的高温超导体中,铊是组成成分之一.已知铊和铝的性质相似,下列关于铊的判断正确的是( )
| A. | 氢氧化铊是两性氢氧化物 | |
| B. | 铊是两性金属 | |
| C. | 铊是金属 | |
| D. | 氧化铊既能与盐酸反应,又能与氢氧化钠溶液反应 |
1.现有下列四个转化,其中不可能通过一步反应实现的是( )
| A. | SiO2→Na2SiO3 | B. | CuO→Cu (OH)2 | C. | SO2→H2SO3 | D. | CaO→Ca(OH)2 |
5.能在水溶液中大量共存的一组离子是( )
| A. | H+、I-、NO3-、CO32- | B. | NH4+、Fe3+、OH-、Br- | ||
| C. | K+、Cl-、Cu2+、NO3- | D. | Al3+、SO42-、Na+、HCO3- |
15.如图装置所示,负极上发生的反应为( )
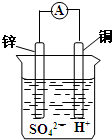

| A. | Zn2++2e-═Zn | B. | Zn-2e-═Zn2+ | C. | Cu-2e-═Cu2+ | D. | Cu2++2e-═Cu |
20.下列物质的水溶液呈碱性的是( )
| A. | FeCl3 | B. | KSCN | C. | CH3COOH | D. | NH4Al(SO4)2 |
 .
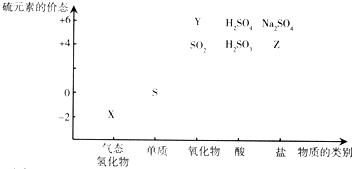
.
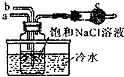 海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源.世界上已知的100多种元素中,80%可以在海水中找到.用化学知识回答下列问题.
海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源.世界上已知的100多种元素中,80%可以在海水中找到.用化学知识回答下列问题.