题目内容
3.下列说法中正确的是( )①干冰在升华时只破坏氢键
②极性分子中肯定含有极性键,则含有极性键的分子一定是极性分子
③离子化合物一定含有离子键,共价化合物中一定不含有离子键
④VIIA族单质从上到下,熔沸点越来越高,IA族单质的熔沸点从上到下也越来越高
⑤H2O分子间存在着氢键,故H2O分子比H2S分子稳定
⑥分子中的键角:CH4>H2O>CO2
⑦HClO4酸性比H2SO4酸性强,说明氯的非金属性比硫强.
| A. | ①②③⑤ | B. | ②④⑥ | C. | ①③⑥ | D. | ③⑦ |
分析 ①干冰为分子晶体,不含氢键;
②含有极性键的分子不一定是极性分子;
③含有离子键的化合物一定为离子化合物;
④晶体类型不同,熔沸点不变规律不同;
⑤氢键与分子的稳定性无关;
⑥二氧化碳为直线形分子,键角为180°;
⑦元素的非金属性越强,对应的氢化物越稳定.
解答 解:①干冰不含氢键,升华时克服范德华力,故错误;
②含有极性键的分子不一定是极性分子,如甲烷等,故错误;
③含有离子键的化合物一定为离子化合物,共价化合物只含共价键,故正确;
④IA族单质为金属降低,熔沸点从上到下逐渐降低,故错误;
⑤H2O分子比H2S分子稳定,是由于共价键键能较大,氢键与分子的稳定性无关,故错误;
⑥二氧化碳为直线形分子,键角为180°,水为V形,甲烷为正四面体形,键角为109°28′,故正确顺序为:CH4<H2O<CO2,故错误;
⑦元素的非金属性越强,对应的氢化物越稳定,故正确.
故选D.
点评 本题考查较为综合,涉及晶体类型、化学键以及物质的性质的递变规律,侧重于学生的分析能力的考查,为高频考点,注意相关基础知识的积累,难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
13.下列化学用语正确的是( )
| A. | Na2S2中硫元素的化合价为-2 | B. | NH4Cl的电子式: | ||
| C. | S2-的结构示意图: | D. | COCl2的电子式: |
14.在同温同压下,下列各组热化学方程式中,△H1<△H2的是( )
| A. | 2H2(气)+O2(气)═2H2O(气)△H1 2H2(气)+O2(气)═2H2O(液)△H2 | |
| B. | S(气)+O2(气)═SO2(气)△H1 S(固)+O2(气)═SO2(气)△H2 | |
| C. | C(固)+$\frac{1}{2}$O2 (气)═CO(气)△H1 C(固)+O2 (气)═CO2(气)△H2 | |
| D. | H2(气)+Cl2(气)═2HCl(气)△H1 $\frac{1}{2}$H2(气)+$\frac{1}{2}$Cl2(气)=HCl(气)△H 2 |
15.如图装置所示,负极上发生的反应为( )


| A. | Zn2++2e-═Zn | B. | Zn-2e-═Zn2+ | C. | Cu-2e-═Cu2+ | D. | Cu2++2e-═Cu |
12.“84”消毒液在日常生活中使用广泛,该消毒液无色,有漂白作用.它的有效成份是下列物质中的一种,这种物质是( )
| A. | KMnO4 | B. | Na2O2 | C. | NH3•H2O | D. | NaClO |
13.某兴趣小组为研究电池原理,设计如图装置.以下叙述不正确的是( )
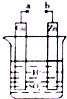

| A. | a和b不连接时,无电流产生,Zn片表面有气泡逸出 | |
| B. | a和b用导线连接,有电流产生,Cu片表面有气泡逸出 | |
| C. | 无论a和b是否连接,Zn片均被腐蚀,溶液的pH均减小 | |
| D. | 若将装置中H2SO4溶液换成CuSO4溶液仍然可以设计成原电池 |
 .
.



