题目内容
在一密闭容器中进行反应:2SO2(g)+O2(g) 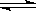 2SO3(g)测得开始时,SO2、O2、和SO3的浓度分别为0.2mol?L-1、0.1mol?L-1、0.2mol?L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是
2SO3(g)测得开始时,SO2、O2、和SO3的浓度分别为0.2mol?L-1、0.1mol?L-1、0.2mol?L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是
 2SO3(g)测得开始时,SO2、O2、和SO3的浓度分别为0.2mol?L-1、0.1mol?L-1、0.2mol?L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是
2SO3(g)测得开始时,SO2、O2、和SO3的浓度分别为0.2mol?L-1、0.1mol?L-1、0.2mol?L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是| A.O2为0.15mol?L-1 | B.SO2为0.25mol?L-1 |
| C.SO3为0.4mol?L-1 | D.O2、SO3的浓度相等 |
C
考查可逆反应的特点。根据原子守恒可知,容器内硫原子的总的物质的量浓度是0.4mol/L,又因为反应是可逆反应,所以三氧化硫的浓度不可能是0.4mol/L,选项C是错误的,其余选项都是正确的,所以答案选C。

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
 HCl+HClO达到平衡后,要使HClO的浓度增加,可加入( )
HCl+HClO达到平衡后,要使HClO的浓度增加,可加入( ) E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L—1。下列说法正确的是
E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L—1。下列说法正确的是  CO(g)+H2(g), CO(g)+H2O(g)
CO(g)+H2(g), CO(g)+H2O(g) N2O4(g)△H<0。
N2O4(g)△H<0。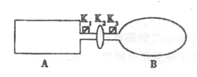
 ?N2O4。反应中测得相关数据如下表所示:
?N2O4。反应中测得相关数据如下表所示: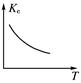
 C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是
C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是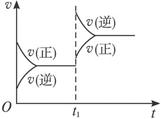
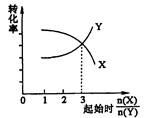
 3Z B 3X+2Y
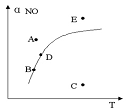
3Z B 3X+2Y 2NO2(g),△H>0,达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且V正<V逆的点是( )
2NO2(g),△H>0,达平衡时NO的转化率与温度的关系,图上标有A、B、C、D、E点,其中表示未达平衡状态且V正<V逆的点是( )