题目内容
(14分)I.A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球.关闭K2,将等量且少量的NO2通过K1、K3分别充入A、B中,反应开始时,A、B的体积相同。已知:2NO2(g)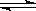 N2O4(g)△H<0。
N2O4(g)△H<0。
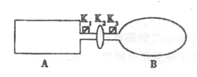
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是V(A) V(B)(填“<”、“>”或“=”);若打开活塞K2,气球B将 (填“变大”、“变小”或“不变”,下同)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将 。
若通入等量的Ne气,则达到平衡时,A中NO2的转化率将 ,B中NO2的转化率将
(3)室温时,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时, 中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的压强为原来的80%,试求出平衡时NO2的转化率 。
II.已知可逆反应:M(g)+N(g)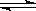 P(g)+Q(g);△H>0,请回答下列问题:①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
P(g)+Q(g);△H>0,请回答下列问题:①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
A、加入一定量M B、加入一定量N C、反应温度升高
D、缩小容器体积 E、加入某物质作催化剂 F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1,c(N)="2.4" mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
③若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1,c(N)=amol·L-1;达到平
衡后,c(P)="2" mol·L-1,a= mol·L-1。
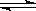 N2O4(g)△H<0。
N2O4(g)△H<0。
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是V(A) V(B)(填“<”、“>”或“=”);若打开活塞K2,气球B将 (填“变大”、“变小”或“不变”,下同)。
(2)若在A、B中再充入与初始量相等的NO2,则达到平衡时,NO2的转化率α(A)将 。
若通入等量的Ne气,则达到平衡时,A中NO2的转化率将 ,B中NO2的转化率将
(3)室温时,若A、B都保持体积不变,将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时, 中的颜色较深。
(4)若在容器A中充入4.6g的NO2,达到平衡后容器内混合气体的压强为原来的80%,试求出平衡时NO2的转化率 。
II.已知可逆反应:M(g)+N(g)
 P(g)+Q(g);△H>0,请回答下列问题:①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为
P(g)+Q(g);△H>0,请回答下列问题:①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为 A、加入一定量M B、加入一定量N C、反应温度升高
D、缩小容器体积 E、加入某物质作催化剂 F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1,c(N)="2.4" mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为 。
③若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1,c(N)=amol·L-1;达到平
衡后,c(P)="2" mol·L-1,a= mol·L-1。
(1)< , 变小 (2)增大,不变, 变小 (3)A (每空各1分)
(4)40%(2分) II①BCF。 ②25%。 ③ 6
(4)40%(2分) II①BCF。 ②25%。 ③ 6
I.(1)A保持恒温恒容,B保持恒温恒压。因为这是一个体积减小的放热的可逆反应,所以在反应过程中,B中的压强大于A中的压强,因此B中反应速率快。若打开活塞K2,则A和B会混合,由于B中压强小于A中压强,所以气球的体积将变小。
(2)A中容器容积不变,所以再增加NO2浓度,相当于增大压强,平衡向正反应方向移动,转化率增大。若通入等量的Ne气,则A中浓度不变,所以平衡不移动,转化率不变。而B中容积必须增大,所以平衡向逆反应方向移动,转化率减小。
(3)因为是放热反应,所以温度高不利于平衡向正反应方向进行,由于A中温度高,所以NO2的浓度大,颜色深。
(4)4.6gNO2是0.1mol,设转化率是x,则生成N2O4是0.05xmol,剩余NO2是0.1×(1-x)mol。所以有0.05xmol+0.1×(1-x)mol=0.1mol×0.8,解得x=0.4。
II. ①因为反应是体积不变的,吸热的可逆反应,所以要增大M的转化率可采取的措施为BCF。
其中A是降低,DE不变。
②M的转化率为60%,则消耗M是0.6mol,则消耗N也是0.6mol,所以N的转化率是0.6÷2.4
=0.25。
③平衡时,c(P)="2" mol·L-1,则消耗Q的浓度也是="2" mol·L-1,消耗M和N的浓度也是="2" mol·L
-1,所以平衡时M的浓度是2mol/L,N的浓度设是(a-2)mol/L。由于温度相同,所以平衡常
数不变,根据②可得出平衡常数,进而可以得出a值。
(2)A中容器容积不变,所以再增加NO2浓度,相当于增大压强,平衡向正反应方向移动,转化率增大。若通入等量的Ne气,则A中浓度不变,所以平衡不移动,转化率不变。而B中容积必须增大,所以平衡向逆反应方向移动,转化率减小。
(3)因为是放热反应,所以温度高不利于平衡向正反应方向进行,由于A中温度高,所以NO2的浓度大,颜色深。
(4)4.6gNO2是0.1mol,设转化率是x,则生成N2O4是0.05xmol,剩余NO2是0.1×(1-x)mol。所以有0.05xmol+0.1×(1-x)mol=0.1mol×0.8,解得x=0.4。
II. ①因为反应是体积不变的,吸热的可逆反应,所以要增大M的转化率可采取的措施为BCF。
其中A是降低,DE不变。
②M的转化率为60%,则消耗M是0.6mol,则消耗N也是0.6mol,所以N的转化率是0.6÷2.4
=0.25。
③平衡时,c(P)="2" mol·L-1,则消耗Q的浓度也是="2" mol·L-1,消耗M和N的浓度也是="2" mol·L
-1,所以平衡时M的浓度是2mol/L,N的浓度设是(a-2)mol/L。由于温度相同,所以平衡常
数不变,根据②可得出平衡常数,进而可以得出a值。

练习册系列答案
相关题目
 qC(g)在密闭容器中进行。如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空
qC(g)在密闭容器中进行。如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线。根据图象填空
 C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率: CH(g)+H2(g) △H1="+156.6" kJ·mol-1
CH(g)+H2(g) △H1="+156.6" kJ·mol-1 CH2(g)= CH4(g)+HC
CH2(g)= CH4(g)+HC Ag2O(s)+SO3(g),2SO3(g)
Ag2O(s)+SO3(g),2SO3(g) 2SO2(g)+O2(g)。10min后反应达到平衡,此时c(SO3)为0.4mol·L-1、c(SO2)为0.1mol·L-1,则下列叙述中不正确的是( )
2SO2(g)+O2(g)。10min后反应达到平衡,此时c(SO3)为0.4mol·L-1、c(SO2)为0.1mol·L-1,则下列叙述中不正确的是( ) 4C(g),
4C(g), H >0达到平衡时,改变条件重新达到平衡后体系中A的转化率增大,可行的是 __
H >0达到平衡时,改变条件重新达到平衡后体系中A的转化率增大,可行的是 __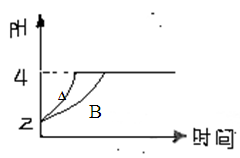
 2SO3(g)测得开始时,SO2、O2、和SO3的浓度分别为0.2mol?L-1、0.1mol?L-1、0.2mol?L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是
2SO3(g)测得开始时,SO2、O2、和SO3的浓度分别为0.2mol?L-1、0.1mol?L-1、0.2mol?L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是 H2(g)+I2(g);DH>0,若降低温度,颜色加深,压强增大
H2(g)+I2(g);DH>0,若降低温度,颜色加深,压强增大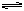 N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为___ _。
N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为___ _。