题目内容
在一定温度下,向体积恒定为2L的密闭容器里充入2mol M和一定量的N,发生如下反应:M(g)+N(g) E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L—1。下列说法正确的是
E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L—1。下列说法正确的是
 E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L—1。下列说法正确的是
E(g);当反应进行到4min时达到平衡,测知M的浓度为0.2mol·L—1。下列说法正确的是 | A.4min时,M的转化率为80% |
| B.4min时,用M表示这段时间内的反应速率为0.8mol·L—1·min—1 |
| C.4min后,向容器中充入不参与反应的稀有气体,M的物质的量减小 |
| D.2min时,M的物质的量浓度为0.6mol·L—1 |
A
平衡时M的物质的量是0.2mol/L×2L=0.4mol,所以消耗M是1.6mol,则转化率是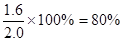 ,A正确。M的反应速率为
,A正确。M的反应速率为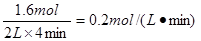 ,B不正确。体积不变,充入稀有气体,平衡不移动,所以M的物质的量不变,C不正确。反应速率在反应过程中是变化的,但不是均匀变化的,所以D不正确。答案选A。
,B不正确。体积不变,充入稀有气体,平衡不移动,所以M的物质的量不变,C不正确。反应速率在反应过程中是变化的,但不是均匀变化的,所以D不正确。答案选A。
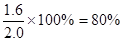 ,A正确。M的反应速率为
,A正确。M的反应速率为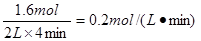 ,B不正确。体积不变,充入稀有气体,平衡不移动,所以M的物质的量不变,C不正确。反应速率在反应过程中是变化的,但不是均匀变化的,所以D不正确。答案选A。
,B不正确。体积不变,充入稀有气体,平衡不移动,所以M的物质的量不变,C不正确。反应速率在反应过程中是变化的,但不是均匀变化的,所以D不正确。答案选A。
练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
 CH3OH(g)
CH3OH(g)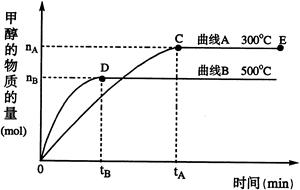
 cC(g) + dD(g) ΔH=Q;根据图回答:
cC(g) + dD(g) ΔH=Q;根据图回答: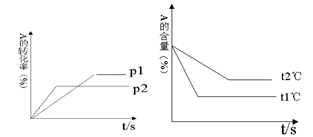
 C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率:
C(g);△H<0,在其他条件不变时,改变其中一个条件,则生成C的速率: CH(g)+H2(g) △H1="+156.6" kJ·mol-1
CH(g)+H2(g) △H1="+156.6" kJ·mol-1 CH2(g)= CH4(g)+HC
CH2(g)= CH4(g)+HC 2C(g)达到化学平衡状态的标志是
2C(g)达到化学平衡状态的标志是 Ag2O(s)+SO3(g),2SO3(g)
Ag2O(s)+SO3(g),2SO3(g) 2SO2(g)+O2(g)。10min后反应达到平衡,此时c(SO3)为0.4mol·L-1、c(SO2)为0.1mol·L-1,则下列叙述中不正确的是( )
2SO2(g)+O2(g)。10min后反应达到平衡,此时c(SO3)为0.4mol·L-1、c(SO2)为0.1mol·L-1,则下列叙述中不正确的是( ) 2SO3(g)测得开始时,SO2、O2、和SO3的浓度分别为0.2mol?L-1、0.1mol?L-1、0.2mol?L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是
2SO3(g)测得开始时,SO2、O2、和SO3的浓度分别为0.2mol?L-1、0.1mol?L-1、0.2mol?L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是 2Z(g),X2、Y2、Z起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不对的是( )
2Z(g),X2、Y2、Z起始浓度分别为0.2 mol·L-1、0.6 mol·L-1、0.4 mol·L-1,当平衡时,下列数据肯定不对的是( )