题目内容
(8分)一定条件下向容积为20 L的密闭容器中充入1 mol NO2气体,发生反应2NO2?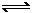 ?N2O4。反应中测得相关数据如下表所示:
?N2O4。反应中测得相关数据如下表所示:
(1)此条件下该反应的化学平衡常数Kc =________。
(2)在50 min末,向容器中加入2/3 mol NO2,若要保持平衡不发生移动,则应加入N2O4________mol。
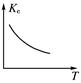
(3)若保持容器体积不发生变化,升高温度,则可得如图图像,据此判断该反应ΔH________0(填“大于”、“小于”或“等于”)。
(4)若在体积不变的情况下,开始充入0.5 mol N2O4,则达到新平衡时N2O4的转化率=________。
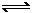 ?N2O4。反应中测得相关数据如下表所示:
?N2O4。反应中测得相关数据如下表所示:| 反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 气体相对分子质量 | 46 | 57 | 64 | 69 | 69 | 69 |
(2)在50 min末,向容器中加入2/3 mol NO2,若要保持平衡不发生移动,则应加入N2O4________mol。
(3)若保持容器体积不发生变化,升高温度,则可得如图图像,据此判断该反应ΔH________0(填“大于”、“小于”或“等于”)。

(4)若在体积不变的情况下,开始充入0.5 mol N2O4,则达到新平衡时N2O4的转化率=________。
(1)60 (2)8/3 mol (3)小于 (4)33.3%
(1)根据表中数据可判断,反应进行到30min时,气体相对分子质量不再发生变化,说明反应达到平衡状态。设生成N2O4的物质的量是x,则消耗NO2是2x,则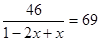 ,解得x=1/3,即平时是NO2和N2O4的浓度都是为1/20mol/L,所以化学平衡常数Kc =
,解得x=1/3,即平时是NO2和N2O4的浓度都是为1/20mol/L,所以化学平衡常数Kc =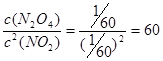 。
。
(2)若要保持平衡不发生移动,则正逆反应速率必须相等,设加入的N2O4为x,则
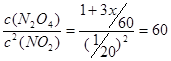 ,解得x=8/3 mol。
,解得x=8/3 mol。
(3)根据图像可知,随着温度的升高,平衡常数逐渐减小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H小于0.
(4)设N2O4的转化率是y,则生成NO2是y。所以有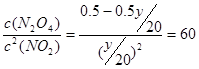 ,解得y=1/3。
,解得y=1/3。
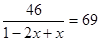 ,解得x=1/3,即平时是NO2和N2O4的浓度都是为1/20mol/L,所以化学平衡常数Kc =
,解得x=1/3,即平时是NO2和N2O4的浓度都是为1/20mol/L,所以化学平衡常数Kc =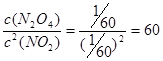 。
。(2)若要保持平衡不发生移动,则正逆反应速率必须相等,设加入的N2O4为x,则
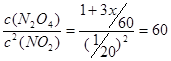 ,解得x=8/3 mol。
,解得x=8/3 mol。(3)根据图像可知,随着温度的升高,平衡常数逐渐减小,说明平衡向逆反应方向移动,所以正反应是放热反应,即△H小于0.
(4)设N2O4的转化率是y,则生成NO2是y。所以有
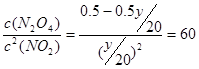 ,解得y=1/3。
,解得y=1/3。
练习册系列答案
 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目

 2C(g)达到化学平衡状态的标志是
2C(g)达到化学平衡状态的标志是 Z(g),经60s达到平衡,生成0.3 mol Z,下列正确的是( )
Z(g),经60s达到平衡,生成0.3 mol Z,下列正确的是( ) 2SO3(g)测得开始时,SO2、O2、和SO3的浓度分别为0.2mol?L-1、0.1mol?L-1、0.2mol?L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是
2SO3(g)测得开始时,SO2、O2、和SO3的浓度分别为0.2mol?L-1、0.1mol?L-1、0.2mol?L-1,在反应过程中不断测该容器中各物质的浓度,下列测定数据肯定不正确的是 3C(g),达到平衡后生成1.5 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为1.2 mol。
3C(g),达到平衡后生成1.5 mol C,此时,平衡混合气中C的体积分数为ω;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为1.2 mol。 3C(g),只有反应到达平衡时才具有的性质是( )
3C(g),只有反应到达平衡时才具有的性质是( )