题目内容
下列实验方法制备气体,合理而又实用的是( )
A锌粒与稀硝酸反应制备氢气 B 将饱和氨水滴加到生石灰中制氨气
C 氯化钡与碳酸反应制备碳酸钡 D 大理石与稀硫酸反应制备二氧化碳
A锌粒与稀硝酸反应制备氢气 B 将饱和氨水滴加到生石灰中制氨气
C 氯化钡与碳酸反应制备碳酸钡 D 大理石与稀硫酸反应制备二氧化碳
B
硝酸是氧化性酸,和锌反应不能生成氢气。生石灰可以吸收氨水中的水,生成强碱,同时放出大量的热,促使氨水分解产生氨气。碳酸的酸性弱于盐酸的,所以不能用氯化钡与碳酸反应制备碳酸钡。大理石与稀硫酸反应生成的硫酸钙微溶,会附着在大理石表面,阻止反应的进行,所以答案是B。

练习册系列答案
相关题目
 ⑤
⑤
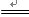 CaSO4 + H2O + CO2↑
CaSO4 + H2O + CO2↑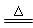 MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O