题目内容
(14分)为测定NaOH溶液的浓度,实验如下:用标准稀盐酸溶液进行滴定
(1)配制100 mL 0.1000mol·L-1盐酸标准溶液所需仪器除量筒、小烧杯、玻璃棒、胶头滴管外,还需要
(2)用 量取20.00 mL待测NaOH溶液放入锥形瓶中,滴加2~3滴酚酞作指示剂,用标准盐酸溶液进行滴定。为减小实验误差,进行了三次实验,假设每次所取NaOH溶液体积均为20.00 mL,三次实验结果如下:
该NaOH溶液的浓度约为____________________
(3)滴定时边滴边摇动锥形瓶,眼睛 ______
(4)下列操作会造成测定结果(待测NaOH溶液浓度值)偏低的有 _____
A. 配制标准溶液定容时,加水超过刻度 B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用标准稀盐酸溶液润洗
D. 滴定到达终点时,俯视读出滴定管读数;
E. 酸式滴定管尖嘴部分有气泡,滴定后消失
F. 摇动锥形瓶时有少量液体溅出瓶外
(5)画出滴定过程中锥形瓶内溶液的pH随滴入标准盐酸溶液体积的变化曲线
(6)中和滴定的装置和相似操作来做其它实验,如据反应I2 + 2S2O32- = 2I- +S4O62-可以用碘水滴定Na2S2O3溶液,应选_作指示剂;据反应2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2+2MnSO4+8H2O可以用酸性KMnO4溶液滴定H2C2O4溶液,KMnO4溶液应装在_______滴定管中。
(1)配制100 mL 0.1000mol·L-1盐酸标准溶液所需仪器除量筒、小烧杯、玻璃棒、胶头滴管外,还需要
(2)用 量取20.00 mL待测NaOH溶液放入锥形瓶中,滴加2~3滴酚酞作指示剂,用标准盐酸溶液进行滴定。为减小实验误差,进行了三次实验,假设每次所取NaOH溶液体积均为20.00 mL,三次实验结果如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗盐酸溶液体积/mL | 19.00 | 23.00 | 23.04 |
(3)滴定时边滴边摇动锥形瓶,眼睛 ______
(4)下列操作会造成测定结果(待测NaOH溶液浓度值)偏低的有 _____
A. 配制标准溶液定容时,加水超过刻度 B. 锥形瓶水洗后直接装待测液
C. 酸式滴定管水洗后未用标准稀盐酸溶液润洗
D. 滴定到达终点时,俯视读出滴定管读数;
E. 酸式滴定管尖嘴部分有气泡,滴定后消失
F. 摇动锥形瓶时有少量液体溅出瓶外
(5)画出滴定过程中锥形瓶内溶液的pH随滴入标准盐酸溶液体积的变化曲线
(6)中和滴定的装置和相似操作来做其它实验,如据反应I2 + 2S2O32- = 2I- +S4O62-可以用碘水滴定Na2S2O3溶液,应选_作指示剂;据反应2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2+2MnSO4+8H2O可以用酸性KMnO4溶液滴定H2C2O4溶液,KMnO4溶液应装在_______滴定管中。
(1)100 mL容量瓶(写容量瓶1分)
(2)碱式滴定管(或移液管); 0.1151 mol·L-1(不写4位有效数字得1分)
(3)注视锥形瓶内溶液颜色的变化
(4)DF (各1分,错选0分)
(5)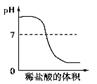 (6)淀粉溶液;酸式(各1分)
(6)淀粉溶液;酸式(各1分)
(2)碱式滴定管(或移液管); 0.1151 mol·L-1(不写4位有效数字得1分)
(3)注视锥形瓶内溶液颜色的变化
(4)DF (各1分,错选0分)
(5)
 (6)淀粉溶液;酸式(各1分)
(6)淀粉溶液;酸式(各1分)(1)准确配制一定物质的量浓度的溶液所需要的仪器还缺少100 mL容量瓶。
(2)氢氧化钠是强碱,应该用碱式滴定管。根据数据可知,第一次实验的数据是无效的,所以取后2次的平均值为23.02ml。因此NaOH溶液的浓度为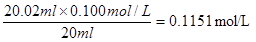
(3)滴定时边滴边摇动锥形瓶,眼睛要始终注视锥形瓶内溶液颜色的变化。
(4)A相当于盐酸的浓度偏低,消耗盐酸的体积就偏大,所以结果偏高。B符合要求,不影响。C也是相当于降低了盐酸的浓度,结果偏高。俯视读出滴定管读数,则读数偏低,则消耗盐酸的体积偏低,测得结果偏低。E中相当于盐酸的体积偏大,结果偏高。F中相当于减少了氢氧化钠的量,消耗盐酸的体积偏低,结果就偏低。
(5)临近终点时pH还会发生突变,如图
(6)碘遇淀粉显蓝色,所以可选择淀粉作指示剂。高锰酸钾溶液具有强氧化性,应该用酸式滴定管。
(2)氢氧化钠是强碱,应该用碱式滴定管。根据数据可知,第一次实验的数据是无效的,所以取后2次的平均值为23.02ml。因此NaOH溶液的浓度为
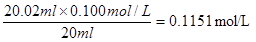
(3)滴定时边滴边摇动锥形瓶,眼睛要始终注视锥形瓶内溶液颜色的变化。
(4)A相当于盐酸的浓度偏低,消耗盐酸的体积就偏大,所以结果偏高。B符合要求,不影响。C也是相当于降低了盐酸的浓度,结果偏高。俯视读出滴定管读数,则读数偏低,则消耗盐酸的体积偏低,测得结果偏低。E中相当于盐酸的体积偏大,结果偏高。F中相当于减少了氢氧化钠的量,消耗盐酸的体积偏低,结果就偏低。
(5)临近终点时pH还会发生突变,如图

(6)碘遇淀粉显蓝色,所以可选择淀粉作指示剂。高锰酸钾溶液具有强氧化性,应该用酸式滴定管。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

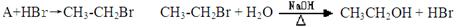
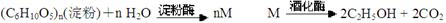
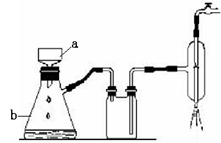
 Cl2↑+MnCl2+2H2O。
Cl2↑+MnCl2+2H2O。