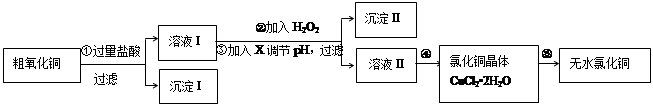
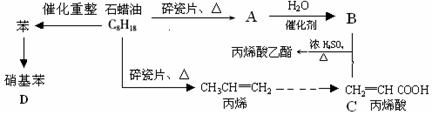
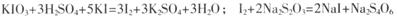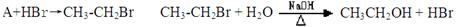题目内容
(10)按要求完成硝酸钾晶体的制备实验:
(1)把上述各步骤中的内容补充完整:a: b:
(2)写出步骤③趁热过滤的目的 ,步骤⑥的操作名称 ,步骤⑦中产生白色沉淀的离子方程式
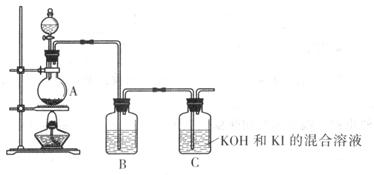
(3)步骤⑥的抽滤装置如图所示,仪器A的名称 ,该装置中的错误之处是 ;抽滤完毕或中途需停抽滤时,应先 ,然后 。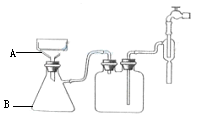
| 步骤 | 操作 | 具体操作步骤 | 现象解释结论等 |
| ① | 溶解 | 取20克NaNO3和17克KCl溶解在35ml水中,加热至沸,并不断搅拌。 | 固体溶解 |
| ② | 蒸发 | 继续加热搅拌,使溶液蒸发浓缩。 | 有 a 晶体析出。 |
| ③ | 热过滤 | 当溶液体积减少到约原来的一半时,迅速趁热过滤 | 滤液中的最主要成分为 b 。 |
| ④ | 冷却 | 将滤液冷却至室温。 | 有晶体析出。 |
 ⑤ ⑤ | | 按有关要求进行操作 | 得到初产品硝酸钾晶体 |
| ⑥ | | 将得到的初产品硝酸钾晶体溶于适量的水中,加热、搅拌,待全部溶解后停止加热,使溶液冷却至室温后抽滤。 | 得到纯度较高的硝酸钾晶体 |
| ⑦ | 检验 | 分别取⑤、⑥得到的产品,配置成溶液后分别加入1滴1mol/l的HNO3和2滴0.1mol/l的AgNO3 | 可观察到⑤、⑥产品中出现的现象分别是⑤产品中产生白色沉淀,⑥产品中无明显现象。 |
(2)写出步骤③趁热过滤的目的 ,步骤⑥的操作名称 ,步骤⑦中产生白色沉淀的离子方程式
(3)步骤⑥的抽滤装置如图所示,仪器A的名称 ,该装置中的错误之处是 ;抽滤完毕或中途需停抽滤时,应先 ,然后 。

(1)NaCl; KNO3
(2)防止因温度降低而析出硝酸钾晶体;重结晶;Ag++ Cl-= AgCl↓
(3) 布氏漏斗;布氏漏斗的颈口斜面未朝向抽滤瓶的支管口;断开连接安全瓶与抽气装置间的橡皮管;关闭抽气装置的水龙头
(2)防止因温度降低而析出硝酸钾晶体;重结晶;Ag++ Cl-= AgCl↓
(3) 布氏漏斗;布氏漏斗的颈口斜面未朝向抽滤瓶的支管口;断开连接安全瓶与抽气装置间的橡皮管;关闭抽气装置的水龙头
(1)氯化钠的溶解度小,蒸发浓缩首先写出氯化钠,即a是氯化钠。硝酸钾的溶解度受温度影响大,所以降低温度时氯化钠析出,则b是硝酸钾。
(2)步骤③趁热过滤的目的防止因温度降低而析出硝酸钾晶体。为了得到纯净的硝酸钾晶体,需要重结晶。氯离子能和银离子反应生成氯化银沉淀,方程式为Ag++ Cl-= AgCl↓。
(3)根据仪器结构特点可知,A是布氏漏斗,抽滤时布氏漏斗的颈口斜面未朝向抽滤瓶的支管口,所以该处是错误的。抽滤完毕或中途需停抽滤时,应先断开连接安全瓶与抽气装置间的橡皮管,然后再关闭抽气装置的水龙头。
(2)步骤③趁热过滤的目的防止因温度降低而析出硝酸钾晶体。为了得到纯净的硝酸钾晶体,需要重结晶。氯离子能和银离子反应生成氯化银沉淀,方程式为Ag++ Cl-= AgCl↓。
(3)根据仪器结构特点可知,A是布氏漏斗,抽滤时布氏漏斗的颈口斜面未朝向抽滤瓶的支管口,所以该处是错误的。抽滤完毕或中途需停抽滤时,应先断开连接安全瓶与抽气装置间的橡皮管,然后再关闭抽气装置的水龙头。

练习册系列答案
相关题目