题目内容
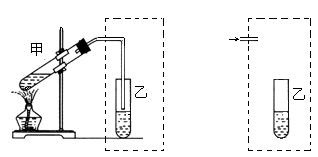
(8分)用如图所示的装置进行制取NO实验(已知Cu与HNO3的反应是放热反应)。
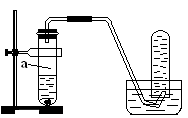
(1)在检查装置的气密性后,向试管a中加入10ml 6 mol·l-1稀HNO3和1gCu片,然后立即用带导管的橡皮塞塞紧试管口。请写出Cu与稀HNO3反应的化学方程式:_______________________________________________________。
(2)实验过程中通常在开始反应时反应速率缓慢,随后逐渐加快,这是由于
_________________________________________________; 进行一段时间后速率
又逐渐减慢,原因是______________________________________________。
(3)欲较快地制得NO,可采取的措施是_____________。

(1)在检查装置的气密性后,向试管a中加入10ml 6 mol·l-1稀HNO3和1gCu片,然后立即用带导管的橡皮塞塞紧试管口。请写出Cu与稀HNO3反应的化学方程式:_______________________________________________________。
(2)实验过程中通常在开始反应时反应速率缓慢,随后逐渐加快,这是由于
_________________________________________________; 进行一段时间后速率
又逐渐减慢,原因是______________________________________________。
(3)欲较快地制得NO,可采取的措施是_____________。
| A.加热 | B.使用铜粉 | C.稀释HNO3 | D.改用浓HNO3 |
(1)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(2)反应放热,使温度升高,反应速率加快;反应一段时间后,硝酸的浓度减小了,反应速率又逐渐减慢。 (3)AB
(2)反应放热,使温度升高,反应速率加快;反应一段时间后,硝酸的浓度减小了,反应速率又逐渐减慢。 (3)AB
(1)稀硝酸具有强氧化性,和铜反应生成硝酸铜、NO和水。
(2)影响反应速率的因素一般是温度和浓度等。随反应的进行,浓度是降低的,但反应速率是逐渐加快的,说明在反应过程中,温度升高导致反应速率加快的,即该反应是放热反应。当反应进行到一定程度时,硝酸的浓度降低,此时浓度的影响超过了温度对反应速率的影响,因此反应速率又降低。
(3)根据外界条件对反应速率的影响,要加快反应速率可以通过升高温度,或增大反应物的接触面积。C是稀释硝酸,浓度降低,反应速率降低。浓硝酸和铜反应的还原产物是NO2。所以正确的答案是AB。
(2)影响反应速率的因素一般是温度和浓度等。随反应的进行,浓度是降低的,但反应速率是逐渐加快的,说明在反应过程中,温度升高导致反应速率加快的,即该反应是放热反应。当反应进行到一定程度时,硝酸的浓度降低,此时浓度的影响超过了温度对反应速率的影响,因此反应速率又降低。
(3)根据外界条件对反应速率的影响,要加快反应速率可以通过升高温度,或增大反应物的接触面积。C是稀释硝酸,浓度降低,反应速率降低。浓硝酸和铜反应的还原产物是NO2。所以正确的答案是AB。

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目