题目内容
8.关于碱金属单质的性质叙述错误的是( )| A. | 在空气中燃烧的生成物都是过氧化物 | |
| B. | 与水反应时都能生成碱和氢气 | |
| C. | 单质的熔沸点随原子序数增加而降低 | |
| D. | 单质的还原性随原子电子层数的增加而增强 |
分析 A.锂在空气中燃烧的生成物为氧化锂;
B.碱金属性质活泼,都能够置换水中的氢气;
C.金属晶体原子半径越大熔沸点越低;
D.碱金属原子半径越大,失去电子的能力越强,金属性越强,单质还原性越强.
解答 解:A.锂在空气中燃烧的生成物为氧化锂,得不到过氧化物,故A错误;
B.碱金属性质活泼,都能够置换水中的氢气,故B正确;
C.碱金属随原子序数增加,原子半径增大,金属键越弱,熔沸点越低,故C正确;
D.碱金属随原子序数增加,电子层数的增加,失去电子的能力越强,金属性越强,单质还原性越强,故D正确;
故选:A.
点评 本题考查了碱金属的性质,熟悉同主族元素性质的递变规律是解题的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.根据电子排布的特点,Co(钴)在周期表属于( )
| A. | s区 | B. | p区 | C. | d 区 | D. | ds区 |
13.已知A2-核内有x个中子,A原子的质量数为m,则ngA2-所含电子的总物质的量是(单位:mol)( )
| A. | $\frac{m-x+2}{m-n}$ | B. | $\frac{n-(m-x)}{m}$ | C. | $\frac{n(m-x+2)}{m}$ | D. | $\frac{n(m-x+2)}{m}$ |
17.CO2的资源化利用是解决温室效应的重要途径.以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应:NH3+CO2→ +H2O(未配平)下列有关三聚氰酸的说法不正确的是( )
+H2O(未配平)下列有关三聚氰酸的说法不正确的是( )
 +H2O(未配平)下列有关三聚氰酸的说法不正确的是( )
+H2O(未配平)下列有关三聚氰酸的说法不正确的是( )| A. | 分子式为C3H3N3O3 | |
| B. | 分子中只含极性键,不含非极性键 | |
| C. | 属于共价化合物 | |
| D. | 该分子中的N原子采用sp杂化、C原子采用sp2杂化 |
18.含有电子数均为3.01×1024的NH3和CH4,两者一定具有相同的( )
| A. | 质量 | B. | 体积 | C. | 物质的量 | D. | 氢原子数 |
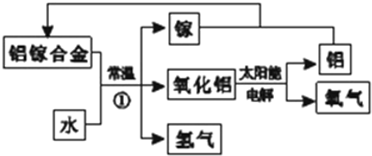 铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中.