题目内容
19.乙醇的沸点是78℃,能与水以任意比混溶.乙醚的沸点为34.6℃,难溶于水,在饱和Na2CO3溶液中几乎不溶,乙醚极易燃烧.实验室制醚的反应原理是:2CH3CH2OH $→_{14℃}^{浓H_{2}SO_{4}}$H2O+CH3CH2-O-CH2CH3(乙醚)
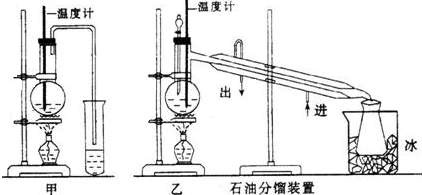
(1)甲图和乙图是两套实验室制乙醚的装置,选装置乙(填“甲”或“乙”)最合理,理由是冷却效果好,乙醚远离火源.
(2)反应液中应加入沸石,其作用是防止暴沸.
(3)反应中温度计的正确位置是水银球置于插入反应物液面以下,但不能触及瓶底
(4)如果温度太高,将会发生副反应,产物为乙烯.
分析 (1)制取乙醚应有冷凝装置(防止乙醚挥发),收集装置不能离火源太近;
(2)液体加热要加碎瓷片,防止暴沸;
(3)反应中需要控制反应温度在140℃,温度计需要测量混合液的温度;
(4)乙醇在浓硫酸作催化剂、脱水剂,如果加热到170℃,则会发生消去反应生成乙烯;
解答 解:(1)通过乙醚的沸点(34.6℃)以及易燃烧可以确定制取乙醚应有冷凝装置(防止乙醚挥发),收集装置不能离火源太近,否则会有危险,
故答案为:乙; 冷却效果好,乙醚远离火源;
(2)因乙醇的沸点低,易暴沸,所以加入沸瓷片作沸石,防暴沸,
故答案为:防止暴沸;
(3)温度计测量的是混合液的温度,所以温度计水银球应该插入反应物液面以下,但不能触及瓶底,
故答案为:插入反应物液面以下,但不能触及瓶底;
(4)乙醇在浓硫酸作催化剂、脱水剂,如果加热到170℃,则会发生消去反应生成乙烯,所以如果温度太高,将会发生副反应,产物为乙烯
故答案为:乙烯.
点评 本题通过实验室制乙醚方法,主要考查了考查了获取信息的能力与对已学知识的迁移能力,本题难度中等.

练习册系列答案
相关题目
1.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 水电离的c(H+)=1×10-12mol•L-1的溶液中:K+、Na+、AlO2-、Cl- | |
| B. | 使石蕊变红色的溶液中:Na+、Al3+、SO42-、CO32- | |
| C. | Kw/C(H+)=1×10-13mol•L-1的溶液中:NH4+、Fe3+、Cl-、NO3- | |
| D. | 与Al反应能放出H2的溶液中:Na+、K+、NO3-、SO42- |
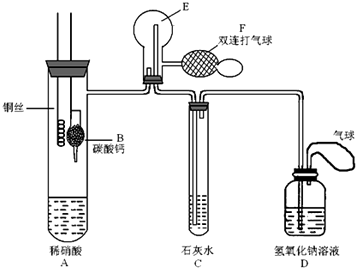
14.硫化碱法是工业上制备Na2S2O3的方法之一,反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2(该反应△H>0),某研究小组在实验室用硫化碱法制备Na2S2O3•5H2O流程如下.

(1)吸硫装置如图所示:

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是品红或溴水或KMnO4溶液.
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是控制SO2的流速、适当升高温度.(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验.(室温时CaCO3饱和溶液的pH=10.2)限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管

(1)吸硫装置如图所示:

①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是品红或溴水或KMnO4溶液.
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是控制SO2的流速、适当升高温度.(写出两条)
(2)假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验.(室温时CaCO3饱和溶液的pH=10.2)限选试剂及仪器:稀硝酸、AgNO3溶液、CaCl2溶液、Ca(NO3)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 有白色沉淀生成 | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH. | 有白色沉淀生成,上层清液pH大于10.2 | 样品含NaOH |
4.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、A12O3等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下:
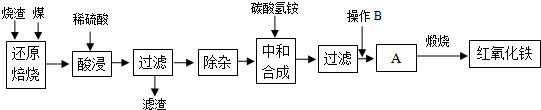
(1)在“还原焙烧”中产生的有毒气体可能有CO、SO2等.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是4Fe2++O2+4H+=4Fe3++2H2O(用离子方程式表示).
(3)根据下表数据:
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于7.11,检验
Fe3+已经除尽的试剂是KSCN溶液.
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是洗涤、干燥.
(5)煅烧A的反应方程式是4FeCO3+O2$\frac{\underline{\;煅烧\;}}{\;}$2Fe2O3+4CO2.
(6)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于$\frac{7b×98%}{10a}$(用含a、b的表达式表示).

(1)在“还原焙烧”中产生的有毒气体可能有CO、SO2等.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是4Fe2++O2+4H+=4Fe3++2H2O(用离子方程式表示).
(3)根据下表数据:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 3.68 | 9.61 |
Fe3+已经除尽的试剂是KSCN溶液.
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是洗涤、干燥.
(5)煅烧A的反应方程式是4FeCO3+O2$\frac{\underline{\;煅烧\;}}{\;}$2Fe2O3+4CO2.
(6)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于$\frac{7b×98%}{10a}$(用含a、b的表达式表示).
11. 过氧化钙(CaO2)是一种白色结晶性粉末,极微溶于水,不溶于醇类、乙醚等.加热至350°C左右开始分解放出氧气,与水缓慢反应中生成H2O2,易与酸反应生成H2O2.过氧化钙可用于改善水质,处理含重金属粒子废水和治理赤潮,也可用于应急供养等,是一种重要化工原料.
过氧化钙(CaO2)是一种白色结晶性粉末,极微溶于水,不溶于醇类、乙醚等.加热至350°C左右开始分解放出氧气,与水缓慢反应中生成H2O2,易与酸反应生成H2O2.过氧化钙可用于改善水质,处理含重金属粒子废水和治理赤潮,也可用于应急供养等,是一种重要化工原料.
Ⅰ.CaO2的制备.
原理:CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl
实验步骤:
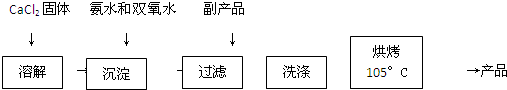
反应装置如图所示:
请回答下面的问题:
(1)a仪器的名称球型冷凝管
(2)加入氨水的作用中和反应生成的HCl,使CaCl2+H2O2?CaO2+2HCl向右进行
(3)沉淀反应时用冰水浴控制温度在0°C左右,其可能的原因是减少双氧水受热分解;降低产物溶解度便于析出(或该反应放热)(写出两种)
(4)过滤后洗涤沉淀的试剂最好用B A.热水 B.冷水 C.乙醇 D.乙醚
Ⅱ.CaO2纯度的测定:将一定量的CaO2溶于稀硫酸,用标准KMnO4溶液滴定生成的H2O2(KMnO4反应后生成Mn2+),计算确定CaO2的含量.
(5)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定,所得的数据如下表所示,则样品的纯度90.00
(6)测得CaO2样品的纯度偏低,其原因可能是AB
A.烘烤时间不足
B.配制KMnO4标准溶液定容时俯视容量瓶刻度线
C.在洁净干燥的酸式滴定管中未润洗即装标准液
D.滴定前尖嘴部分有气泡,滴定后消失.
 过氧化钙(CaO2)是一种白色结晶性粉末,极微溶于水,不溶于醇类、乙醚等.加热至350°C左右开始分解放出氧气,与水缓慢反应中生成H2O2,易与酸反应生成H2O2.过氧化钙可用于改善水质,处理含重金属粒子废水和治理赤潮,也可用于应急供养等,是一种重要化工原料.
过氧化钙(CaO2)是一种白色结晶性粉末,极微溶于水,不溶于醇类、乙醚等.加热至350°C左右开始分解放出氧气,与水缓慢反应中生成H2O2,易与酸反应生成H2O2.过氧化钙可用于改善水质,处理含重金属粒子废水和治理赤潮,也可用于应急供养等,是一种重要化工原料.Ⅰ.CaO2的制备.
原理:CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl
实验步骤:

反应装置如图所示:
请回答下面的问题:
(1)a仪器的名称球型冷凝管
(2)加入氨水的作用中和反应生成的HCl,使CaCl2+H2O2?CaO2+2HCl向右进行
(3)沉淀反应时用冰水浴控制温度在0°C左右,其可能的原因是减少双氧水受热分解;降低产物溶解度便于析出(或该反应放热)(写出两种)
(4)过滤后洗涤沉淀的试剂最好用B A.热水 B.冷水 C.乙醇 D.乙醚
Ⅱ.CaO2纯度的测定:将一定量的CaO2溶于稀硫酸,用标准KMnO4溶液滴定生成的H2O2(KMnO4反应后生成Mn2+),计算确定CaO2的含量.
(5)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定,所得的数据如下表所示,则样品的纯度90.00
| 实验序号 | ① | ② | ③ | ④ |
| 消耗 KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
A.烘烤时间不足
B.配制KMnO4标准溶液定容时俯视容量瓶刻度线
C.在洁净干燥的酸式滴定管中未润洗即装标准液
D.滴定前尖嘴部分有气泡,滴定后消失.
9.常温时,将a1mL,b1mol/L 的CH3COOH溶液加入到a2mL,b2mol/L 的NaOH溶液中,下列结论中不正确的是( )
| A. | 如果a1b1=a2b2,则混合溶液的pH>7 | |
| B. | 如果混合液的pH=7,则混合溶液中c(CH3COO-)=c(Na+) | |
| C. | 如果a1=a2,b1=b2,则混合液液中c(CH3COO-)=c(Na+) | |
| D. | 如果a1=a2,且混合溶液的pH<7,则b1>b2 |
 ,用单线桥法分析上述反应.
,用单线桥法分析上述反应.