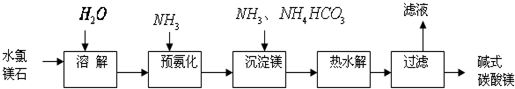
题目内容
4.硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、A12O3等杂质).用该烧渣制取药用辅料--红氧化铁的工艺流程如下: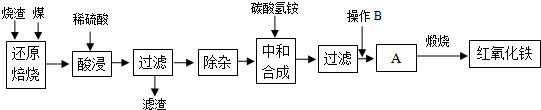
(1)在“还原焙烧”中产生的有毒气体可能有CO、SO2等.
(2)“酸浸”时间一般不超过20min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是4Fe2++O2+4H+=4Fe3++2H2O(用离子方程式表示).
(3)根据下表数据:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 3.68 | 9.61 |
Fe3+已经除尽的试剂是KSCN溶液.
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,则操作B是洗涤、干燥.
(5)煅烧A的反应方程式是4FeCO3+O2$\frac{\underline{\;煅烧\;}}{\;}$2Fe2O3+4CO2.
(6)a g烧渣经过上述工艺可得红氧化铁b g.药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于$\frac{7b×98%}{10a}$(用含a、b的表达式表示).
分析 工业废渣主要含Fe2O3及少量SiO2、A12O3、CaO、MgO等杂质,加煤燃烧可生成CO、SO2等有毒气体,加硫酸后只有二氧化硅不反应,酸浸时间过长,溶液中Fe2+含量将下降,被氧化生成Fe3+,过滤除去二氧化硅,然后除杂时结合生成沉淀的pH可知,pH大于4.77,小于7.11时Fe3+和Al3+完全转化为沉淀,而亚铁离子没有转化为沉淀,“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,过滤得到A为碳酸亚铁,需要洗涤、干燥,然后加热得到氧化铁,以此来解答.
(1)加煤燃烧可生成CO、SO2等有毒气体;
(2)亚铁离子被氧化为铁离子;
(3)除去Fe3+和Al3+,依据图表中沉淀所需PH分析判断,检验铁离子可以使用KSCN溶液;
(4)A为碳酸亚铁,需要洗涤、干燥;
(5)煅烧A(FeCO3)生成氧化铁和二氧化碳,原子守恒配平书写化学方程式;
(6)制得的红氧化铁中含氧化铁不得少于98.0%,制取的红氧化铁bg中含有的铁的物质的量应该大于:
$\frac{bg×98%}{160g/mol}$×2=$\frac{b×98%}{80}$mol,据此计算质量分数;
解答 解:工业废渣主要含Fe2O3及少量SiO2、A12O3、CaO、MgO等杂质,加煤燃烧可生成CO、SO2等有毒气体,加硫酸后只有二氧化硅不反应,酸浸时间过长,溶液中Fe2+含量将下降,被氧化生成Fe3+,过滤除去二氧化硅,然后除杂时结合生成沉淀的pH可知,pH大于4.77,小于7.11时Fe3+和Al3+完全转化为沉淀,而亚铁离子没有转化为沉淀,“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,过滤得到A为碳酸亚铁,需要洗涤、干燥,然后加热得到氧化铁,
(1)由上述分析可知,“还原焙烧”中产生的有毒气体可能有CO、SO2等,
故答案为:CO、SO2等;
(2)在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是4Fe2++O2+4H+=4Fe3++2H2O,
故答案为:4Fe2++O2+4H+=4Fe3++2H2O;
(3)除去Fe3+和Al3+,依据图表中沉淀所需PH分析,溶液PH小于7.11时,亚铁离子不沉淀,铁离子和铝离子完全沉淀,检验铁离子可以使用KSCN溶液,
故答案为:7.11;KSCN溶液;
(4)A为碳酸亚铁,需要洗涤、干燥,然后加热得到氧化铁,
故答案为:洗涤、干燥;
(5)煅烧A(FeCO3)生成氧化铁,反应方程式为:4FeCO3+O2$\frac{\underline{\;煅烧\;}}{\;}$2Fe2O3+4CO2,
故答案为:4FeCO3+O2$\frac{\underline{\;煅烧\;}}{\;}$2Fe2O3+4CO2;
(6)制得的红氧化铁中含氧化铁不得少于98.0%,制取的红氧化铁bg中含有的铁的物质的量应该大于:
$\frac{bg×98%}{160g/mol}$×2=$\frac{b×98%}{80}$mol,则所选用的烧渣中铁的质量分数应不低于:$\frac{\frac{b×98%}{80}×56g/mol}{ag}$=$\frac{7b×98%}{10a}$,故答案为:$\frac{7b×98%}{10a}$;
点评 本题考查制备实验方案的设计,为高频考点,把握制备原理及实验流程中的反应、物质的性质等为解答的关键,侧重分析与实验、计算能力的综合考查,题目难度中等.

| A. | 1:3 | B. | 3:1 | C. | 2:3 | D. | 3:2 |
| A. | 标准状况下,11.2 L SO3所含的分子数为0.5 NA | |
| B. | 12 g石墨和C60的混合物中质子总数一定为6NA个 | |
| C. | 在熔融状态下,l mol NaHSO4完全电离出的阳离子数目为2NA | |
| D. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |