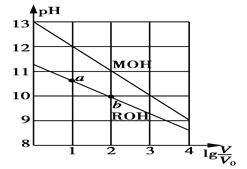
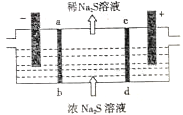
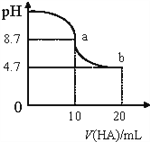
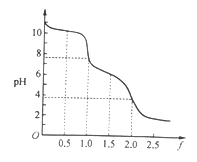
题目内容
【题目】往含有H+、Fe2+、Cu2+、Ag+四种离子的溶液中加入足量镁粉,最先得到的还原产物是( )
A.H2
B.Fe
C.Cu
D.Ag
【答案】D
【解析】四种离子中Ag+的氧化性最强,故镁粉先与Ag+反应。
所以答案是:D
【考点精析】解答此题的关键在于理解氧化性、还原性强弱的比较的相关知识,掌握金属阳离子的氧化性随其单质还原性的增强而减弱;非金属阴离子的还原性随其单质的氧化性增强而减弱;不同的氧化剂与同一还原剂反应时,反应条件越易,其氧化剂的氧化性越强;当不同的氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强.

 阅读快车系列答案
阅读快车系列答案【题目】乙二醛(OHC-CHO)化学性质活泼,是纺织工业中常用的一种有机原料,能增加棉花、尼龙等纤维的防缩性和防皱性。其工业生产方法主要是乙二醇(HOCH2CH2OH)气相催化氧化法和乙醛液相硝酸氧化法。请回答下列相关问题:
(1)乙二醇气相催化氧化法
以乙二醇、氧气为原料,在催化剂存在的条件下,250℃左右开始缓慢进行,生成乙二醛和副产物乙醇酸[CH2(OH)COOH]的反应方程式:
I.HOCH2CH2OH(g)+O2(g) ![]() OHC-CHO(g)+2H2O(g)△H1
OHC-CHO(g)+2H2O(g)△H1
II.HOCH2CH2OH(g)+O2(g) ![]() CH2(OH)COOH(g)+H2O(g)△H2
CH2(OH)COOH(g)+H2O(g)△H2
已知反应I中相关化学键键能数据如下:
化学键 | C-H | C-O | H-O | O==O | C==O | C-C |
E/kJ·mol-1 | 413 | 343 | 465 | 498 | 728 | 332 |
①△H1=_____kJ/mol,反应I的化学平衡常数表达式为K=________。
②欲提高I的平衡产率,可以采取的措施是______(填标号)。
A.升高温度 B.增大压强 C.降低温度 D.减小压强
③提高乙二醛反应选择性的关键因素是_________________________。
④保持温度和容积不变,下列描述能说明反应I达到平衡状态的是________(填标号)。
A.v正(O2)=2v逆(H2O)
B.混合气体的压强不再随时间变化而变化
C.混合气体的密度不再发生变化
D.乙二醇与OHC-CHO的物质的量之比为1:1
E.混合气体中乙二醛的体积分数不再发生变化
(2)乙醛(CH3CHO)液相硝酸氧化法
11.0g40%的乙醛溶液和40%的硝酸,按一定比例投入氧化反应釜内,在Cu(NO3)2催化下,控制温度在38~40℃时,反应10h,再通过萃取等操作除去乙醛、硝酸等,最后经减压浓缩得4.35g40%乙二醛溶液。
①用稀硝酸氧化乙醛制取乙二醛时,有N2O产生。其化学方程式为______________________。
②利用上面数据,计算乙二醛的产率为___________________________。