题目内容
【题目】浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg![]() 的变化如图所示。下列叙述正确的是
的变化如图所示。下列叙述正确的是
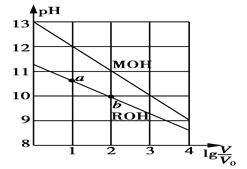
A. MOH为弱碱,ROH为强碱
B. ROH的电离程度:a点大于b点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当lg![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
【答案】C
【解析】常温下,0.10 mol·L-1的MOH的PH=13,0.10 mol·L-1的ROH溶液的PH<13,所以MOH为强碱,ROH为弱碱,故A错误;弱电解质越稀电离程度越大,ROH的电离程度:b点大于a点,故B错误;若两溶液无限稀释,最终接近中性,所以它们的c(OH-)相等,故C正确;两溶液同时升高温度,MOH中M+浓度不变,ROH溶液中电离平衡正向移动,R+浓度增大,所以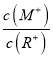 减小,故D错误。
减小,故D错误。

【题目】已知草酸晶体(H2C2O4·XH2O)可溶于水,并可与酸性高锰酸钾溶液完全反应:2KMnO4+5H2C2O4+3H2SO4==K2SO4+2MnSO4+10CO2↑+8H2O。现用氧化还原滴定法测定草酸晶体的结晶水分子数X,步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,三次结果如下:
第一次滴定 | 第二次滴定 | 第三次滴定 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知H2C2O4的相对分子质量为90,请回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在________(填酸式或碱式)滴定管中。
(2)在整个实验过程中,不需要的仪器或用品是______(填序号)。
①100mL容量瓶②烧杯③滴定管夹④漏斗⑤玻璃棒⑥托盘天平
(3)到达滴定终点的标志是____________________________________________。
(4)根据上述数据计算X=________________。
(5)误差分析(填偏高、偏低或无影响):
①若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值________;
②若KMnO4标准溶液浓度偏低,则X值_________;
③若锥形瓶洗净后瓶内还残留有少量蒸馏水,则X值____________。
【题目】对下列现象或事实的解释不正确的是
现象或事实 | 解释 | |
A | CO2 气体缓缓通入包裹有 Na2O2 粉末的棉花,棉花很快燃烧起来 | Na2O2 与 CO2 反应放出热量 |
B | 将 Na2O2、Na2O 分别溶于水,再往其中滴入酚酞,最终溶液均变红色 | Na2O2、Na2O 都是碱性氧化物 |
C | Na 投入水中会熔成光亮的小球 | Na 与水反应放热且钠的熔点低 |
D | 工业上常用钠冶炼金属钛: | Na 具有强还原性 |
A. A B. B C. C D. D
