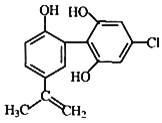
题目内容
【题目】Ⅰ、前20号元素A、B、C、D,其中A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C。
(1)C在周期表中的位置__________________________;
(2)B 元素的原子结构示意图____________________________;
(3)化合物D2C的电子式______________________________;
(4)B最简单气态氢化物与最简单的有机物的稳定性强弱关系(用相应的化学式表示):____ > ____;
(5)C、D离子的半径大小关系为C______D (填:>、=、<);
(6)B的氢化物与B的最高价氧化物对应水化物反应的生成物中含有的的化学键有__________填选项)。
A、只含离子键 B、既有离子键又有共价健
C、只含有共价键 D、既有极性共价键又有非极性共价键
Ⅱ、利用下图装置来验证同主族元素非金属性的变化规律:
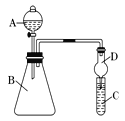
(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾溶液,观察到C中溶液现象是:___________,即可证明。干燥管D的作用是___________________。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用_________________溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,将观察到C中______________的现象。但老师认为,该现象不足以证明酸性强弱关系为碳酸>硅酸,因此应在B、D之间增加一个盛有足量__________的洗气装置(选填下列字母)
A.浓盐酸 B.浓NaOH溶液 C.饱和Na2CO3溶液 D.饱和NaHCO3溶液
【答案】 第三周期 第ⅥA族 ![]()
![]() NH3 CH4 > B 溶液变蓝 防倒吸 【答题空10】NaOH 有白色沉淀 D
NH3 CH4 > B 溶液变蓝 防倒吸 【答题空10】NaOH 有白色沉淀 D
【解析】I.A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等,则A为H元素;B的原子半径是其所在主族中最小的,处于第二周期,B的最高价氧化物对应水化物的化学式为HBO3,最高正化合价为+5,处于ⅤA族,则B为N元素;C元素原子的最外层电子数比次外层少2个,则C应有三个电子层,最外层电子数为6,则C为S元素;C的阴离子与D的阳离子具有相同的电子排布,离子核外电子数为18,两元素可形成化合物D2C,D在第四周期第ⅠA族,则D为K;
(1)由以上分析,C为S元素,位于元素周期表中第三周期第ⅥA族;
(2)B为N元素,其原子序数为7,氮原子的原子结构示意图为:![]() ;
;
(3)D2C为K2S,属于离子化合物,含有离子键,其电子式为:![]() ;
;
(4)B的氢化物为氨气,最简单的有机物为甲烷,非金属性N>C,则二者的稳定性:NH3>CH4;
(5)C为S、D为K,离子的电子层越多,离子半径越大,电子层相同时,核电荷数越大,离子半径越小,硫离子比钾离子的电子层相同,钾离子的核电荷数大于硫离子,则硫离子半径大于钾离子,即:C>D;
(6)B的氢化物为氨气,B的最高价氧化物对应水化物为硝酸,二者反应的生成物为硝酸铵,硝酸铵为离子化合物,其化学式中既含有离子键,也含有共价键,故B正确,故答案为B;
Ⅱ.(1)KMnO4与浓盐酸常温下反应生成氯气,氯气把碘化钾氧化为碘单质,淀粉遇碘变蓝色,因此观察到C中溶液变蓝;氯气易溶于水,需要防止倒吸,而D为肚容式防倒吸装置,所以干燥管D的作用是防止溶液倒吸;氯气能与强碱发生反应,因此可用NaOH溶液吸收尾气;
(2)根据较强酸制较弱酸原理,酸性HCl>H2CO3>H2SiO3,HCl或CO2都能与Na2SiO3溶液反应生成硅酸沉淀,因此C中出现白色沉淀生成;正是由于从B中挥发出的HCl也会和硅酸钠溶液反应生成硅酸,所以该现象不足以证明酸性强弱关系为碳酸>硅酸;需要把二氧化碳中混有的HCl除去,可选用饱和NaHCO3溶液,而浓盐酸易挥发、浓氢氧化钠溶液和饱和碳酸钠溶液即可吸收HCl也可吸收二氧化碳;故答案为D。