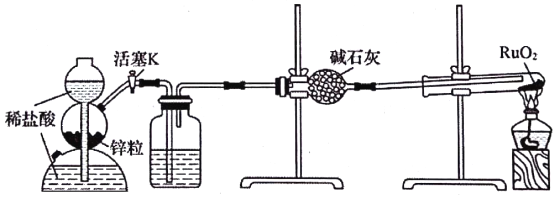
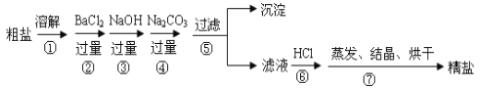
题目内容
【题目】(1)从1L1mol/LNaOH溶液中取出100mL,则这100mLNaOH溶液的物质的量浓度是____mol/L,含NaOH的质量____g。
(2)某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,该HCl气体的物质的量为______,可知所配成的盐酸溶液的物质的量浓度为_____。
(3)在标准状况下15gCO与CO2的混合气体,体积为11.2L。则:
①混合气体的密度是_____。
②混合气体的平均摩尔质量是______。
③CO2和CO的体积之比是_______。
④CO的体积分数是______。
⑤CO2和CO的质量之比是_______。
⑥CO的质量分数是______。
⑦混合气体中所含氧原子的物质的量是_____。
【答案】1 4 2mol 4mol/L 1.339g/L 30g/mol 1:7 87.5% 11:49 81.7% 0.5625mol
【解析】
根据n=m/M、n=V/Vm、c=n/V,结合阿伏加德罗定律、气体摩尔体积和物质的组成分析计算。
(1)溶液是均一稳定的,从1L1mol/LNaOH溶液中取出100mL,则这100mLNaOH溶液的物质的量浓度仍然是1 mol/L,含NaOH的质量1mol/L×0.1L×40g/mol=4 g。
(2)某同学将标准状况下44.8L的HCl气体溶于水,配成500mL的溶液,该HCl气体的物质的量为44.8L÷22.4L/mol=2mol,因此所配成的盐酸溶液的物质的量浓度为2mol÷0.5L=4mol/L。
(3)在标准状况下15gCO与CO2的混合气体,体积为11.2L。则:
①混合气体的密度是15g÷11.2L=1.339g/L。
②混合气体的物质的量是0.5mol,则混合气体的平均摩尔质量是15g÷0.5mol=30g/mol。
③设混合气体中CO与CO2的物质的量分别是xmol、ymol,则28x+44y=15、11.2÷22.4=x+y,解得x=7/16、y=1/16,则CO2和CO的体积之比是1:7。
④CO的体积分数是![]() =87.5%。
=87.5%。
⑤CO2和CO的质量之比是1×44:7×28=11:49。
⑥CO的质量分数是![]() =81.7%。
=81.7%。
⑦混合气体中所含氧原子的物质的量是7/16mol+1/16mol×2=0.5625mol。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案