题目内容
【题目】向恒温恒压容器中充入2 mol NO、1 mol O2,发生反应:2NO(g)+O2(g) ![]() 2NO2(g)。下列情况不能说明反应已达到平衡状态的是( )
2NO2(g)。下列情况不能说明反应已达到平衡状态的是( )
A. 容器体积不再改变 B. 混合气体的颜色不再改变
C. 混合气体的密度不再改变 D. NO与O2的物质的量的比值不再改变
【答案】D
【解析】
A、反应在恒温恒压条件下进行,若反应未达平衡则容器体积变化,若体积不变则达平衡状态,选项A不选;B、NO2为红棕色气体,其他反应物为无色气体,若混合气体的颜色不再改变,则反应达平衡状态,选项B不选;C、反应在恒温恒压条件下进行,若反应未达平衡则容器体积变化,气体总质量不变,则密度变化,若密度不变则达到平衡,选项C不选;D、充入2 mol NO、1 mol O2,且两反应物质的化学计量数之比为2:1,则无论反应是否达平衡,NO与O2的物质的量的比值均为2:1,不再改变,选项D选。答案选D。

【题目】金属Na、Mg、Al有广泛的应用。
(1)Al在元素周期表中的位置是__________________。
(2)金属镁可以用来生产金属铀(元素符号是U):UF4+2Mg![]() U+2MgF2,该反应中,作为还原剂的物质是_________(填化学式,下同),被还原的物质是_________。
U+2MgF2,该反应中,作为还原剂的物质是_________(填化学式,下同),被还原的物质是_________。
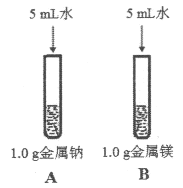
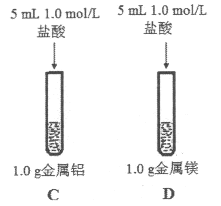
(3)为比较Na、Mg、Al的金属性,进行了如下实验(金属固体的表面积都相同):
实验1 | 实验2 |
|
|
钠与水反应剧烈,镁与水反应缓慢 | 镁与盐酸反应剧烈,铝与盐酸反应缓慢 |
由实验1和实验2得出的结论是:金属性_________>_________>_________(填元素符号),用原子结构理论解释:同周期元素从左到右,_________。
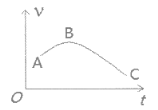
(4)把镁条(去除氧化膜)投入到盛有盐酸的敞口容器中,产生H2的速率v与时间t的关系如图所示,AB段速率增大的主要原因是__________________。