题目内容
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
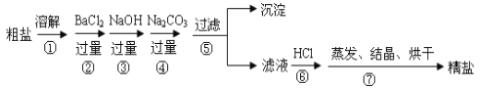
(1)在第①步粗盐溶解操作中要用玻璃棒搅拌,作用是___________________________。
(2)第②步操作的目的是除去粗盐中的__________(填化学式),判断BaCl2已过量的方法是____________________________________________________________。
(3)在第③步操作中,选择的除杂的试剂不能用KOH代替NaOH,理由是________________。
(4)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、________、__________。
(5)“蒸发结晶”用到的器材有:铁架台(铁圈)、坩埚钳、酒精灯、火柴、玻璃棒、______。
(6)第④步除原食盐中杂质离子与碳酸根的反应外还有的反应的离子方程式为:______________________________;
(7)第⑥步操作中涉及反应的离子方程式有:__________________、__________________。
【答案】加速固体溶解 Na2SO4 或SO42- 取少量上层清液于试管中滴入几滴氯化钡溶液,若无白色沉淀生成则说明氯化钡已经过量 若用氢氧化钾会引入新的杂质氯化钾 CaCO3 Mg(OH)2、BaCO3 蒸发皿 CO32-+Ba2+==BaCO3↓ CO32-+2H+=H2O+CO2↑ OH-+H+=H2O
【解析】
实验流程为:粗盐样品含有Na2SO4、MgCl2、CaCl2等杂质,①加入过量的氯化钡,将硫酸根离子除去,引入钡离子杂质离子,②加入过量氢氧化钠溶液的目的是除去氯化镁,③加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2,⑤过滤,将得到的沉淀全部滤出,得到的滤液是含有氯化钠、碳酸钠、氢氧化钠等的混合物,⑥加入足量的盐酸,可以出去碳酸根离子、氢氧根离子等杂质离子,⑦最后即可获得较为纯净的氯化钠。
(1)粗盐溶解时通过玻璃杯的搅拌可以加速溶解;
(2)加入氯化钡溶液可除去杂质硫酸根离子;
(3)若用氢氧化钾溶液,会引进杂质钾离子;
(4)过滤可把溶液和不溶于水的物质除去,可以除去硫酸钡、碳酸钙、碳酸镁、碳酸钡和泥沙等不溶性杂质;
(5)根据蒸发操作方法判断使用的仪器及缺少的仪器;
(6)碳酸钠与氯化钡、氯化钙反应分步生成碳酸钡和碳酸钙沉淀,据此写出反应的化学方程式;
(7)第⑥步用盐酸中和碳酸钠、氢氧化钠.
实验流程为:粗盐样品含有Na2SO4、MgCl2、CaCl2等杂质,①加入过量的氯化钡,将硫酸根离子除去,引入钡离子杂质离子,②加入过量氢氧化钠溶液的目的是除去氯化镁,③加入过量的碳酸钠溶液的目的除去杂质CaCl2和加入的过量试剂BaCl2,⑤过滤,将得到的沉淀全部滤出,得到的滤液是含有氯化钠、碳酸钠、氢氧化钠等的混合物,⑥加入足量的盐酸,可以出去碳酸根离子、氢氧根离子等杂质离子,⑦最后即可获得较为纯净的氯化钠。
(1)第①步粗盐溶解操作中用玻璃棒搅拌,可加速粗盐的溶解;
(2)加入氯化钡溶液可以除去杂质Na2SO4或硫酸根离子;继续加入氯化钡溶液,若无沉淀生成,则说明氯化钡已经过量,所以判断BaCl2已过量的方法是:取少量上层清液与试管中加入氯化钡溶液,若白色沉淀生成则氯化钡已经过量;
(3)提纯的是氯化钠,若用氢氧化钾会引入新的杂质氯化钾;
(4)通过过滤可把溶液中的不溶物除去,则可以除去的物质有泥沙、BaSO4、Mg(OH)2、BaCO3;CaCO3;
(5)根据“蒸发结晶”的步骤可知,蒸发过程用到的仪器有:铁架台(铁圈)、坩埚钳、石棉网、火柴、玻璃棒、酒精灯、蒸发皿,缺少蒸发皿;
(6)第④步加入碳酸钠,碳酸钠与氯化钡、氯化钙反应生成碳酸钙和碳酸钡沉淀,反应的化学方程式为:Na2CO3+BaCl2=BaCO3+2NaCl、Na2CO3+CaCl2=CaCO3+2NaCl,第④步除原食盐中杂质离子与碳酸根的反应外还有的反应的离子方程式为:CO32-+Ba2+==BaCO3↓ ;
(7)第⑥步加入盐酸的目的是除去过量的碳酸钠和氢氧化钠,反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2、NaOH+HCl=NaCl+H2O,第⑥步操作中涉及反应的离子方程式有:CO32-+2H+=H2O+CO2↑ 、OH-+H+=H2O。

【题目】利用铜萃取剂M,通过如下反应实现铜离子的富集:
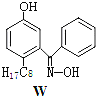
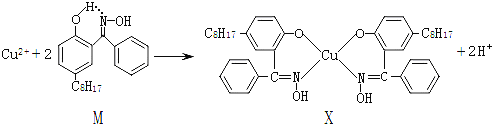
(1)关于M所含元素的说法正确的是______________。
A.电负性由大到小顺序:O>N>C>H
B.第一电离能由大到小的顺序:O>N>C
C.氮原子以sp2杂化轨道与氧原子形成σ键
D.从物质分类角度M属于芳香烃,M中所有的碳原子不可能共面
E.组成M元素的氢化物稳定性:CH4<H2O<NH3
(2)上述反应中断裂和生成的化学键有_______(填序号)。
A.氢键 B.配位键 C.金属键 D.范德华力 E.共价键 F.离子键
(3)M与W(分子结构如上图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是_______________。
(4)基态Cu2+的外围电子排布图为________________,Cu2+等过渡元素水合离子是否有颜色与原子结构有关,且存在一定的规律。判断Sc3+、Zn2+的水合离子为无色的依据是_____________________________________________________________。
离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
(5)已知:Y原子最高价氧化物对应水化物的酸性最强。铜与Y形成化合物的晶胞如附图所示(黑点代表铜原子,空心圆代表Y原子)。
①该晶体的化学式为_______________。(用元素符号表示)
②已知铜和Y原子的电负性分别为1.9和3.0,则铜与Y原子形成的化合物属于____________(填“离子”或“共价”)化合物。
③已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子与Y原子之间的最短距离为_______________pm(只写计算式)。