题目内容
1.H+离子与NH3分子反应生成NH4+离子,它们之间的相互作用是( )| A. | 分子间的作用 | B. | 非极性共价键 | C. | 离子键 | D. | 配位键 |
分析 一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有孤电子对和含有空轨道的原子之间易形成配位键,氢离子提供空轨道,氮原子提供孤电子对,据此分析解答.
解答 解:氢离子结构示意图为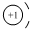 ,氢离子中不含电子只含空轨道,氨气的电子式为
,氢离子中不含电子只含空轨道,氨气的电子式为 ,NH3分子中N原子含有孤电子对,所以氢离子和NH3分子生成的铵根离子中存在配位键,铵根离子电子式为:
,NH3分子中N原子含有孤电子对,所以氢离子和NH3分子生成的铵根离子中存在配位键,铵根离子电子式为: ,
,
故选D.
点评 本题考查配位键的判断,明确配位键的概念即可解答,注意配位键属于共价键,氢键属于分子间作用力,为易错点.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
12.下列表示物质结构的化学用语或说法中,正确的是( )
| A. | CCl4分子的每个原子都满足8电子稳定结构 | |
| B. | HF的电子式: | |
| C. | 次氯酸的电子式: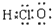 | |
| D. | NaCl的电子式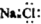 |
9.某卤代烃中化学键如图所示,则下列说法正确的是( )


| A. | 发生水解反应时,被破坏的键是①和③ | |
| B. | 发生消去反应时,被破坏的键是①和③ | |
| C. | 发生水解反应时,被破坏的键是③ | |
| D. | 发生消去反应时,被破坏的键是①和② |
16.下列叙述中,错误的是( )
| A. | 离子化合物中可能含有非极性键 | |
| B. | 原子晶体中分子间作用力越强,熔点越高 | |
| C. | 原子晶体中可能含有非极性键 | |
| D. | 氯化钠晶体熔化时离子键发生断裂 |
20.咖啡酸的结构简式为,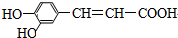
现有①氯化氢 ②溴水 ③纯碱溶液 ④2-丙醇 ⑤酸化的高锰酸钾溶液 ⑥新制氢氧化铜悬浊液.试根据其结构特点判断在一定条件下能与咖啡酸反应的物质组合是( )
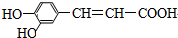
现有①氯化氢 ②溴水 ③纯碱溶液 ④2-丙醇 ⑤酸化的高锰酸钾溶液 ⑥新制氢氧化铜悬浊液.试根据其结构特点判断在一定条件下能与咖啡酸反应的物质组合是( )
| A. | 只有②④⑤⑥ | B. | 只有①③④⑥ | C. | 只有①②③⑤ | D. | ①②③④⑤⑥ |
 某学校实验小组同学欲探究温度对化学平衡的影响,做如下实验:
某学校实验小组同学欲探究温度对化学平衡的影响,做如下实验: