题目内容
【题目】请按要求填空:
(1)C、N元素形成的新材料具有如图所示的结构该晶体的化学式为________________。
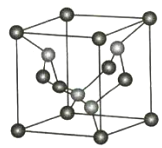
![]() C(位于顶点和面心)
C(位于顶点和面心)![]() N
N
(2)氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大、熔点高、化学性质稳定。
①氮化硅的硬度________(填“大于”或“小于”)氮化碳的硬度,原因是___________________________。
②已知氮化硅的晶体结构中,原子间都以单键相连,且氮原子与氮原子不直接相连、硅原子与硅原子不直接相连,同时每个原子都满足最外层8电子稳定结构,请写出氮化硅的化学式:______________。
(3)第ⅢA、VA元素组成的化合物GaN、GaP、CaAs等是人工合成的新型半导体材料,其晶体结构与晶体硅相似。在GaN晶体中,每个Ga原子与________个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为________。在四大晶体类型中,GaN属于________晶体。
【答案】C3N4 小于 硅原子半径大于碳原子半径,氮碳形成的共价键键长比氮硅形成的共价键键长短,故氮碳形成的共价键的键能大 Si3N4 4 正四面体形 原子
【解析】
(1)根据晶胞结构计算化学式,角上原子计![]() ,棱上原子计
,棱上原子计![]() ,面上原子计
,面上原子计![]() ,内部原子计1;
,内部原子计1;
(2)①原子晶体键长越短,键能越大,晶体硬度越大;②根据最外层8电子稳定结构,写出氮化硅的化学式;
(3)GaN晶体与晶体硅结构相似,为原子晶体,空间构型为正四面体结构。
(1)根据晶胞的结构可知含有碳原子数目![]() ,氮原子数目为4,则化学式为:C3N4,故答案为:C3N4;
,氮原子数目为4,则化学式为:C3N4,故答案为:C3N4;
(2)①氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大、熔点高、化学性质稳定,这说明二者形成的晶体都是原子晶体,由于硅原子半径大于碳原子半径,氮碳形成的共价键键长比氮硅形成的共价键键长短,键能大,所以氮化硅的硬度小于氮化碳的硬度,故答案为:小于;硅原子半径大于碳原子半径,氮碳形成的共价键键长比氮硅形成的共价键键长短,故氮碳形成的共价键的键能大;
②N的最外层电子数为5,要满足8电子稳定结构,需要形成3个共价键,Si的最外层电子数为4,要满足8电子稳定结构,需要形成4个共价键,所以氮化硅的化学式为:Si3N4,故答案为:Si3N4;
(3)GaN的晶体结构与晶体硅相似,则GaN属于原子晶体,每个Ga原子与4个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为正四面体形,故答案为:4;正四面体形;原子。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案