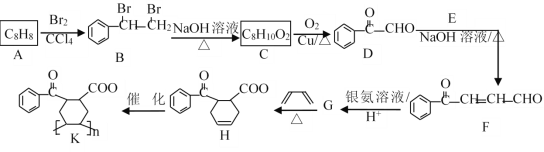
题目内容
【题目】氮的化合物在国防建设、工农业生产和生活中有广泛的用途。请回答下列问题:
(1)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。
① 若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=_________________mol·L1。
②将SO2通入2.0 mol·L-1氨水中(溶液的体积保持不变),当c(OH)降至1.0×107 mol·L1时,溶液中的![]() =______;(NH4)2SO3溶液中的质子守恒____________。
=______;(NH4)2SO3溶液中的质子守恒____________。
(2)室温时,向100 mL 0.1 mol·L-1HCl溶液中滴加0.1 mol·L-1氨水,得到溶液pH与氨水体积的关系曲线如图所示:
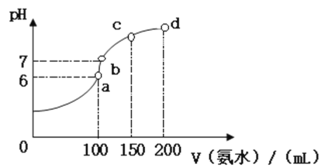
①试分析图中a、b、c、d四个点,水的电离程度最大的是_________;
②在b点,溶液中各离子浓度由大到小的排列顺序是___________;
③写出a点混合溶液中下列算式的精确结果(不能近似计算):c(Cl-)- c(NH4+)=____________,c(H+)- c(NH3·H2O)=____________;
(3)亚硝酸(HNO2)的性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数Ka=5.1×10-4;H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11。常温下向含有2mol碳酸钠的溶液中加入含1mol HNO2的溶液后,溶液中CO32-、HCO3-和NO2-的浓度由大到小的顺序是______ 。
【答案】0.6×102 0.62 c(H+)+c(HSO3-)+2c(H2SO3)=c(NH3·H2O)+c(OH-) a c(Cl-)= c(NH4+)>c(OH-)=c(H+) 10-6-10-8 10-8 c(HCO3-)>c(NO2-)>c(CO32-)
【解析】
(1)①NH3·H2O电离方程式为NH3·H2ONH4++OH-,c(NH4+)=c(OH-),的Kb= ;
;
②将SO2通入2.0 mol·L-1氨水中(溶液的体积保持不变),当c(OH)降至1.0×107 mol·L1时,溶液呈中性,根据HSO3-的电离平衡常数计算;根据(NH4)2SO3溶液中质子守恒式=电荷守恒-物料守恒;
(2)①根据反应a、b、c、d四个点,a点恰好消耗完H+,溶液中只有NH4Cl,b、c、d三点溶液中均含有NH3H2O,NH4Cl可以促进水的电离,而NH3H2O抑制水的电离,b点溶液呈中性;
②b点溶液为中性,溶质为NH4Cl和NH3H2O,根据电荷守恒分析;
③a点溶液中只有NH4Cl,铵根离子水解使溶液显酸性,根据电荷守恒和质子守恒计算;
(3)弱酸电离常数越大,酸性越强,其酸根离子水解程度越小。
(1)①NH3·H2O电离方程式为NH3·H2ONH4++OH-,c(NH4+)=c(OH-),的Kb=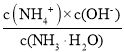 ,c(OH-)=
,c(OH-)=![]() =
=![]() =0.6×102 mol·L1;
=0.6×102 mol·L1;
②将SO2通入2.0 mol·L-1氨水中(溶液的体积保持不变),当c(OH)降至1.0×107 mol·L1时,溶液呈中性,c(OH)=c(H+)=1.0×107 mol·L1根据HSO3-H++ SO32-,电离平衡常数Ka2=![]() =6.2×108,则
=6.2×108,则![]() =
=![]() =0.62; (NH4)2SO3溶液电荷守恒:c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),物料守恒:c(NH4+)+ c(NH3·H2O)=2c(SO32-)+2c(HSO3-)+2c(H2SO3),质子守恒=电荷守恒-物料守恒=c(H+)+c(HSO3-)+2c(H2SO3)=c(NH3H2O)+ c(OH-);
=0.62; (NH4)2SO3溶液电荷守恒:c(NH4+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),物料守恒:c(NH4+)+ c(NH3·H2O)=2c(SO32-)+2c(HSO3-)+2c(H2SO3),质子守恒=电荷守恒-物料守恒=c(H+)+c(HSO3-)+2c(H2SO3)=c(NH3H2O)+ c(OH-);
(2)①根据反应a、b、c、d四个点,a点恰好消耗完H+,溶液中只有NH4Cl,b、c、d三点溶液中均含有NH3H2O,NH4Cl可以促进水的电离,而NH3H2O抑制水的电离,b点溶液呈中性,所以a点水的电离程度最大;
②b点溶液为中性,c(OH-)= c(H+),溶质为NH4Cl和NH3H2O,溶液中存在电荷守恒式为:c(NH4+)+ c(H+)= c(Cl-)+c(OH-),则c(NH4+)= c(Cl-),水的电离是极弱的,离子浓度的大小为c(NH4+)=c(Cl-)>c(H+)=c(OH-);
③a点溶液中只有NH4Cl,铵根离子水解使溶液显酸性,pH=6,即c(H+)=10-6mol/L,c(OH-)=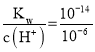 =10-8 mol/L,溶液中存在电荷守恒式为:c(NH4+)+c(H+)= c(Cl-)+c(OH-),c(Cl-)- c(NH4+)= c(H+)- c(OH-)=10-6mol/L-10-8 mol/L=(10-6-10-8) mol/L;溶液中存在质子守恒:c(H+) = c(OH-)+ c(NH3H2O) ,c(H+)- c(NH3·H2O)= c(OH-)=10-8 mol/L;
=10-8 mol/L,溶液中存在电荷守恒式为:c(NH4+)+c(H+)= c(Cl-)+c(OH-),c(Cl-)- c(NH4+)= c(H+)- c(OH-)=10-6mol/L-10-8 mol/L=(10-6-10-8) mol/L;溶液中存在质子守恒:c(H+) = c(OH-)+ c(NH3H2O) ,c(H+)- c(NH3·H2O)= c(OH-)=10-8 mol/L;
(3)由亚硝酸的电离平衡常数Ka=5.1×10-4;H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11,可知溶液中完全反应生成等物质的量的Na2CO3、NaHCO3和NaNO2,可判断水解程度大小顺序为CO32>NO2>HCO3,水解生成HCO3,所以溶液中CO32离子、HCO3离子和NO2离子的浓度大小关系为c(HCO3)>c(NO2)>c(CO32)。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。其中J为0族元素。
X | Y | Z | |
R | |||
W | |||
J |
下列说法正确的是( )
A.基态R原子的轨道表示式为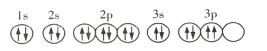
B.![]() 与
与![]() 的半径大小关系为
的半径大小关系为![]()
C.Y的第一电离能大于X的第一电离能
D.X、Y、Z、R、W中,电负性最大的元素为W
【题目】在2L 恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(s),所得实验数据如下表:
M(g)+N(s),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | n(N) | ||
① | 800 | 0.10 | 0.40 | 0.080 | 0.080 |
② | 800 | 0.20 | 0.80 | a | a |
③ | 900 | 0.10 | 0.15 | 0.06 | 0.06 |
下列说法正确的是( )
A.实验① 5min达平衡,平均反应速率v(X)=0.016mol/(L·min)
B.实验②中,该反应的平衡常数K=1
C.实验②中,达到平衡时,a小于0.16
D.正反应为吸热反应