题目内容
9.甲醇是一种重要的可再生能源.(1)已知2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a KJ/mol
CO(g)+2H2(g)=CH3OH(g)△H=b KJ/mol试写出由CH4和O2制取甲醇的热化学方程式:2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol.
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况.从反应开始到达平衡,用H2表示平均反应速率υ(H2)=0.15mol/(L•min).
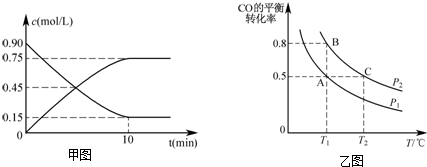
(3)在一容积可变的密闭容器中充入10mol CO和20mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示.
①下列说法能判断该反应达到化学平衡状态的是BD.(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA<PB(填“>、<、=”).
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molH2,则在平衡状态B时容器的体积V(B)=4L.
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极).
①若KOH溶液足量,则写出电池总反应的离子方程式:2CH3OH+3O2+4OH-=2CO32-+6H2O.
②若电解质溶液中KOH的物质的量为0.8mol,当有0.5mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是C(K+)>C(CO32-)>C(HCO3-)>C(OH-)>C(H+).
分析 (1)利用盖斯定律,1式加2式的二倍即可得到该方程式及焓变;
(2)根据反应速率v=$\frac{△c}{△t}$,结合物质表示的反应速率之比等于物质前边的系数之比来计算;
(3)①平衡标志是正逆反应速率相同,各成分浓度保持不变分析判断选项;
②正反应方向为气体体积减小的方向,T1℃时比较CO的转化率,转化率越大,则压强越大;
③A、B反应温度相等,则平衡常数相等,利用平衡常数计算;
(4)①燃料电池总反应是燃料燃烧的化学方程式,在碱性环境下,二氧化碳转化为碳酸根离子,据此书写;
②当有0.5mol甲醇参与反应时,产生的二氧化碳是0.5mol,和0.8mol氢氧化钾反应,根据元素守恒可以计算n (K2CO3)=0.3mol,n (KHCO3)=0.2mol,据此确定离子浓度的大小顺序.
解答 解:(1)已知①2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a KJ/mol
②CO(g)+2H2(g)=CH3OH(g)△H=b KJ/mol,①+②×2可得到2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol,故答案为:2CH4(g)+O2(g)=2CH3OH(g)△H=(a+2b)kJ/mol;
(2)用甲醇表示的反应速率v=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),氢气表示的反应速率是甲醇的2倍,即0.15mol/(L•min),故答案为:0.15mol/(L•min);
(3)A.H2的消耗速率等于CH3OH的生成速率的2倍,不能说明正逆反应速率相等,不一定平衡,故A错误;
B.H2的体积分数不再改变是化学平衡的特征,达到了平衡,故B正确;
C.体系中H2的转化率和CO的转化率相等,不能说明正逆反应速率相等,不一定平衡,故C错误;
D.体系中气体的平均摩尔质量等于质量和物质的量的比值,物质的量变化,质量不变,所以当体系中气体的平均摩尔质量不再改变,证明达到了平衡,故D正确.
故选BD.
②正反应方向为气体体积减小的方向,T1℃时比较CO的转化率,转化率越大,则压强越大,图象中PB转化率大于PA,可知PA<PB,故答案为:<;
③A、B两容器温度相同,即化学平衡常数相等,且B点时CO的转化率为0.8,
则 CO(g)+2H2(g)?CH3OH(g)
起始(mol):10 20 0
转化(mol):8 16 8
平衡(mol):2 4 8
设体积为VL,则有K=$\frac{\frac{8}{V}}{\frac{2}{V}•(\frac{4}{V})^{2}}$=4,V=4L,
故答案为:4L;
(4)①燃料电池总反应是燃料燃烧的化学方程式,在碱性环境下,二氧化碳转化为碳酸根离子,即2CH3OH+3O2+4OH-=2CO32-+6H2O,
故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O;
②当有0.5mol甲醇参与反应时,产生的二氧化碳是0.5mol,和0.8mol氢氧化钾反应,根据元素守恒可以计算n (K2CO3)=0.3mol,n (KHCO3)=0.2mol,二者的水溶液均为碱性,所以C(K+)>C(CO32-)>C(HCO3-)>C(OH-)>C(H+),
故答案为:C(K+)>C(CO32-)>C(HCO3-)>C(OH-)>C(H+).
点评 本题主要考查了热化学方程式的书写、化学平衡状态的判断、平衡的计算以及燃料电池中电极反应的书写和溶液中离子浓度的大小比较知识,属于综合知识的考查,难度大.

 X、Y、Z、W、R、T是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
X、Y、Z、W、R、T是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:| 元素 | 相关信息 |
| X | 元素最高正价与最低负价的绝对值相等 |
| Y | 是地壳中含量最多的元素 |
| Z | 元素基态原子3p能级只有一个电子 |
| W | 与Z位于同周期,能量最高的p 能级电子为半充满 |
| R | 单质为黄色固体,常存在于火山喷发口 |
| T | 元素基态原子核未成对电子最多 |
(1)R位于元素周期表第三周期第ⅥA族;T的基态原子核外电子排布式为1s22s22p63s23p63d54s1.
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 离子还原性 | 最高价氧化物的熔点 |
| W>R | Y>Z | Y<R | X<Z |
 (或
(或 ).
).(4)Y及其同主族元素的氢化物沸点变化趋势如图所示,其中Y的氢化物沸点最高的原因是水分子间可以形成氢键,大大加强了分子间作用力,从而使水的沸点最高.
(5)在101KPa、25℃下,由最稳定单质生成1mol该化合物是的热效应称为该化合物的标准生成焓(△H).已知Z2O3标准生成焓(△H)为:△H=-399.09kJ/mol,T2O3的标准生成焓(△H)为:△H=-269.70kJ/mol,试写出单质Z和T2O3反应的热化学方程式2Al(s)+Cr2O3(s)=2Cr+Al2O3(s)△H=-129.39kJ/mol.
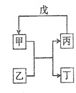 甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化).下列各组物质中,不满足图示转化关系的是( )| 选项 | 甲 | 乙 | 丙 | 戊 |
| A | NH3 | O2 | NO | H2O |
| B | Fe | H2O | H2 | Fe2O3 |
| C | Al(OH)3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| D | Na2O2 | CO2 | O2 | Na |
| A. | A | B. | B | C. | C | D. | D |
| A. | 乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| B. | 高锰酸钾溶液和双氧水的消毒原理相同 | |
| C. | 双氧水具有较强的腐蚀性,不能用于清洗创口 | |
| D. | 在次氯酸钠溶液中通入少量二氧化硫可得到亚硫酸钠和次氯酸 |
| A. | 四氯化碳的电子式 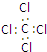 | B. | 乙炔的最简式 CH≡CH | ||
| C. | 聚乙烯的结构简式为 CH2=CH2 | D. | 丙烷的分子结构模型示意图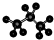 |
| A. | 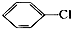 | B. | CH3CH2CH2Br | ||
| C. | 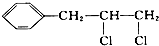 | D. | 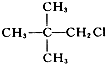 |
| A. | 乙炔和丁炔 | B. | 乙烷和丁烷 | C. | 苯和甲苯 | D. | 乙炔和苯 |
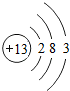 ,Al(OH)3的碱性比Mg(OH)2弱(填“强”或“弱”).
,Al(OH)3的碱性比Mg(OH)2弱(填“强”或“弱”). .
.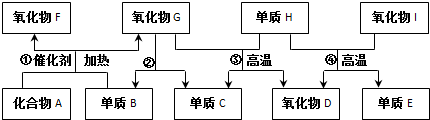
 .氧化物I中化学键类型:共价键.组成E单质的元素在元素周期表中的位置是第三周期第ⅣA族.图中物质所含元素原子的半径由大到小依次是(写元素符号)Si、C、N、O、H.
.氧化物I中化学键类型:共价键.组成E单质的元素在元素周期表中的位置是第三周期第ⅣA族.图中物质所含元素原子的半径由大到小依次是(写元素符号)Si、C、N、O、H. N2O4.
N2O4.