题目内容
19.两种物质不论以什么质量比混合,只要混合物的质量一定,充分燃烧时产生的水的量总为定值,这组混合物是( )| A. | 乙炔和丁炔 | B. | 乙烷和丁烷 | C. | 苯和甲苯 | D. | 乙炔和苯 |
分析 无论以何种比例混合,只要混合物的总质量一定,完全燃烧生成水的质量也一定,则说明混合物各组分含H量相等,若是由烃组成混合物,则最简式相同,以此解答该题.
解答 解:无论以何种比例混合,只要混合物的总质量一定,完全燃烧生成H2O的质量也一定,则说明混合物各组分分子中含氢量相等,烃的最简式应相同,
A.乙炔和丁炔的分子式分别为C2H2、C3H4,最简式不同,则含氢量不同,不满足题意,故A错误;
B.乙烷和丁烷的分子式分别为C2H6、C4H10,最简式不同,则含氢量不同,不满足题意,故B错误;
C.苯和甲苯的分子式分别为C6H6、C7H8,最简式不同,则含氢量不同,不满足题意,故C错误;
D.苯和乙炔:二者的最简式都是CH,分子中的含H量相等,符合题意,故D正确.
故选D.
点评 本题考查有机物燃烧的有关计算,为高频考点,题目难度不大,注意只要总质量一定,完全燃烧时生成水的质量也一定,则说明混合物各组分的分子中含H量相等.

练习册系列答案
相关题目
7.下列鉴别方法不可行的是( )
| A. | 用KMnO4(H+)溶液鉴别甲苯、丙烯、已烷 | |
| B. | 用溴水鉴别苯、丙烯、四氯化碳 | |
| C. | 用水鉴别乙醇、苯、四氯化碳 | |
| D. | 用NaOH溶液鉴别苯酚溶液、甲苯、硝基苯 |
14.已知莽草酸结构简式如图所示.下列说法正确的是( )


| A. | 该分子中含有2种官能团 | |
| B. | 可与FeCl3溶液作用显紫色 | |
| C. | 1 mol莽草酸可与4 mol NaOH或2molBr2完全反应 | |
| D. | 在一定条件下,该物质既可发生加成反应也可发生取代反应 |
11.将2.4g镁和铝的混合物粉末溶于75mL 4mol/L的盐酸中,反应一段时间后,再加入250mL 1.5mol/L的NaOH溶液后待反应完全,此时溶液中大量存在的是( )
| A. | Na+、Mg2+ | B. | Na+、Al3+、Mg2+ | C. | Na+、Mg2+、[Al(OH)4]- | D. | Na+、[Al(OH)4]- |
9.关于下列各图的叙述,正确的是( )
| A. | 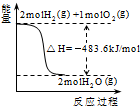 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ•mol-1 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ•mol-1 | |
| B. | 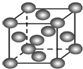 表示Cu形成金属晶体时的堆积方式 表示Cu形成金属晶体时的堆积方式 | |
| C. | 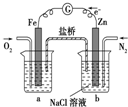 装置中烧杯a中的溶液pH降低 装置中烧杯a中的溶液pH降低 | |
| D. |  装置中待镀铁制品应与电源正极相连 装置中待镀铁制品应与电源正极相连 |
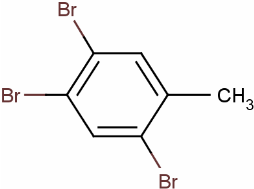 +3HBr.
+3HBr. 碳族元素的单质及其化合物是一类重要物质.请回答下列问题:
碳族元素的单质及其化合物是一类重要物质.请回答下列问题: ,其中碳氧原子之间共价键是c(填序号).
,其中碳氧原子之间共价键是c(填序号).