题目内容
1.下列卤代烃一定能发生消去反应的是( )| A. | 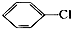 | B. | CH3CH2CH2Br | ||
| C. | 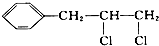 | D. | 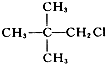 |
分析 卤代烃发生消去反应结构特点:与-X相连碳相邻碳上有氢原子才能发生反应,形成不饱和键,否则不会发生消去反应,据此进行判断即可.
解答 解:A、 苯环上连接侧链的碳原子上没有氢原子,无法发生消去反应,故A错误;
苯环上连接侧链的碳原子上没有氢原子,无法发生消去反应,故A错误;
B、CH3CH2CH2Br能发生消去反应生成丙烯,故B正确;
C、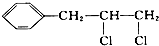 ,此分子中的两个Cl均能发生消去反应,故C正确;
,此分子中的两个Cl均能发生消去反应,故C正确;
D、 与氯原子相连的碳原子的邻位的C原子上不含有氢原子,所以不能发生消去反应,故D错误;
与氯原子相连的碳原子的邻位的C原子上不含有氢原子,所以不能发生消去反应,故D错误;
故选BC.
点评 本题考查卤代烃发生消去反应结构特点,难度不大,注意掌握卤代烃能发生消去反应结构特点:与-X相连的碳原子的邻位碳原子上必须有氢原子.

练习册系列答案
相关题目
12.化学与社会、生活密切相关.下列现象或事实的解释正解的是( )
| 选项 | 现象或事实 | 解释 |
| A | 常温下将Al片放入浓硝酸中无明显变化 | Al与浓硝酸不反应 |
| B | 加热滴有酚酞的醋酸钠溶液,溶液红色变深 | 加热促进CH3COO-水解,溶液的碱性增强 |
| C | 将溴水分别滴入植物油和裂化汽油中,溴水均褪色 | 前者由于萃取而褪色,后者由于发生加成反应而褪色 |
| D | 加热NaHCO3溶液无明显变化 | NaHCO3的热稳定性强 |
| A. | A | B. | B | C. | C | D. | D |
16.下列各组中的反应,属于同一反应类型的是( )
| A. | 由溴乙烷制乙烯;由石油制乙烯 | |
| B. | 由乙烯制乙烷;由乙醇制乙醛 | |
| C. | 乙烯使溴水褪色;甲苯使酸性KMnO4溶液褪色 | |
| D. | 由硝酸与苯反应制硝基苯;甲烷与Cl2光照 |
6.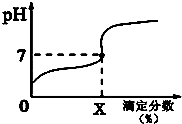 常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是( )
常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是( )
 常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是( )
常温下,用0.1000mol/L的NaOH溶液滴定20ml同浓度的一元弱酸HA,滴定过程溶液pH随X的变化曲线如图所示(忽略中和热效应),下列说法不正确的是( )| A. | HA溶液加水稀释后,溶液中$\frac{c(HA)}{c({A}^{-})}$的值减小 | |
| B. | HA的电离常数KHA=$\frac{1{0}^{-7}X}{100-X}$(x为滴定分数) | |
| C. | 当滴定分数为100时,溶液中水的电离程度最大 | |
| D. | 滴定分数大于100时,溶液中离子浓度关系一定是c(Na+)>c(A-)>c(OH-)>c(H+) |
13.下列各图与表述一致的是( )
| A. | 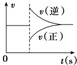 图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| B. | 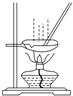 用图所示装置蒸发AlCl3溶液制备无水AlCl3 用图所示装置蒸发AlCl3溶液制备无水AlCl3 | |
| C. | 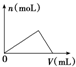 图可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化 图可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化 | |
| D. | 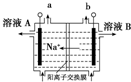 图电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B 图电解饱和食盐水的装置中,溶液A、B中由水电离出的c(H+):A>B |
11.将2.4g镁和铝的混合物粉末溶于75mL 4mol/L的盐酸中,反应一段时间后,再加入250mL 1.5mol/L的NaOH溶液后待反应完全,此时溶液中大量存在的是( )
| A. | Na+、Mg2+ | B. | Na+、Al3+、Mg2+ | C. | Na+、Mg2+、[Al(OH)4]- | D. | Na+、[Al(OH)4]- |
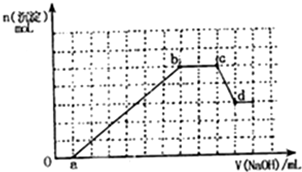 某无色溶液中可能含有H+,NH4+,Mg2+,Fe3+,Al3+,SO42-,HCO3-等离子,当向溶液中加入一定浓度NaOH溶液,生成沉淀物质的量随加入NaOH溶液体积关系如图所示.
某无色溶液中可能含有H+,NH4+,Mg2+,Fe3+,Al3+,SO42-,HCO3-等离子,当向溶液中加入一定浓度NaOH溶液,生成沉淀物质的量随加入NaOH溶液体积关系如图所示.