题目内容
6.已知氢气的燃烧热为285.8kJ/mol,CO的燃烧热为282.8kJ/mol;现有氢气和CO组成的混合气体56.0L(标准状况),经充分燃烧后,放出总热量710.0kJ,并生成液态水.下列说法正确的是( )| A. | CO燃烧的热化学方程为2CO(g)+O2(g)=2CO2(g)△H=+282.8 kJ/mol | |
| B. | H2燃烧的热化学方程为2H2(g)+O2(g)=2H2O(g)△H=-571.6 kJ/mol | |
| C. | 燃烧前混合气体中H2的体积分数为40% | |
| D. | 燃烧后的气体与足量的过氧化钠作用可产生1.50 mol氧气 |
分析 A、依据一氧化碳燃烧热分析判断,一氧化碳燃烧是放热反应焓变为负值;
B、氢气燃烧热是1mol氢气完全燃烧生成液态水放出的热量分析;
C、依据氢气和一氧化碳燃烧热的热化学方程式分析计算判断;
D、据H2和CO各自的物质的量,据原子守恒得到水和二氧化碳的物质的量求出过氧化钠物质的量即可求得.
解答 解:A、一氧化碳燃烧热为282.8kJ/mol,依据燃烧热概念,热化学方程式为,CO(g)+$\frac{1}{2}$O2(g)═CO2(g);△H=-282.8 kJ/mol,故A错误;
B、氢气燃烧热为285.8kJ/mol,热化学方程式为:2H2(g)+O2(g)═2H2O(l);△H=-571.6 kJ/mol,选项中为水蒸气不是我的氧化物,故B错误;
C、H2和CO组成的混合气体56.0L(标况)物质的量为2.5mol,经充分燃烧后,放出总热量为710kJ,并生成液态水,依据氢气和一氧化碳燃烧热的热化学方程式计算,设氢气物质的量为x,一氧化碳物质的量为y,则x+y=2.5,285.8x+282.8y=710,计算得到x=1,y=1.5,燃烧前混合气体中H2的体积百分数=$\frac{1}{2.5}$×100%=40%,故C正确;
D、氢气1mol,CO有1.5mol,则生成水和二氧化碳分别为1mol和1.5mol,据氢气、CO和过氧化钠反应的方程式分析,可知能反应掉过氧化钠的物质的量为2.5mol,生成氧气的物质的量为1.25mol,故D错误;
故选C.
点评 本题考查了热化学方程式的书写方法和燃烧热概念的理解应用,氧化还原反应电子定量计算的分析,需用到的知识点和方法相对较多.D也可通过守恒思路解答,即氢气和CO共有多少,发生上述反应转移电子就是多少,题目难度中等.

| A. | 电子层结构相同的粒子随核电荷的递增半径逐渐增大 | |
| B. | CsCl、NaBr、CaF2、LiI四种化合物中LiI的阴阳离子半径之比值最大 | |
| C. | S2-半径小于硫原子半径 | |
| D. | 无法比较K+、Al3+、O2-、Cl-的半径大小 |
| A. | 雾霾天气仅影响出行能见度,对人体健康没有影响 | |
| B. | 减少化石燃料燃烧和汽车尾气排放,是减少雾霾发生的有效措施 | |
| C. | 当光束分别通过雾霾和豆浆时,仅豆浆可看到一条光亮的“通路” | |
| D. | 气候环境报告中新增的“PM2.5”就是雾霾 |
| A. | 乙醇催化氧化制乙醛 | B. | 乙醇与浓硫酸共热制乙烯 | ||
| C. | 苯乙烯在一定条件下制聚苯乙烯 | D. | 溴乙烷制乙醇 |
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A. | 乙的常见氧化物有两种 | |
| B. | 气态氢化物稳定性:丙>丁 | |
| C. | 丙的氧化物能与戊的氢化物的水溶液反应 | |
| D. | 原子半径大小:甲>丙 |
| X | Y | ||
| Z | W |
| A. | X元素Z能形成气态氢化物XH3 | B. | Z与W形成的化合物在熔融时能导电 | ||
| C. | 自然界存在大量的单质Z | D. | X与Y形成的化合物不超过3种 |
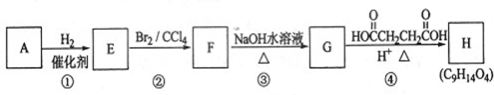
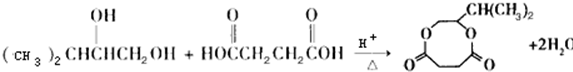 ;
;