题目内容
11.在${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H、${\;}_{12}^{23}$Mg、${\;}_{12}^{24}$Mg和${\;}_{29}^{65}$Cu中共有3种元素,6种原子,中子数最多的是${\;}_{29}^{65}$Cu.分析 核电荷数相同的一类原子为一种元素;核素是指具有一定数目质子和一定数目中子的同一种原子;根据中子数=质量数-质子数进行计算.
解答 解:在${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H为氢元素的3种不同核素;${\;}_{12}^{23}$Mg、${\;}_{12}^{24}$Mg为镁元素的2种不同核素,${\;}_{29}^{65}$Cu为铜元素的一种核素,故共有3种元素,6种原子;
${\;}_{1}^{1}$H的中子数为0、${\;}_{1}^{2}$H的中子数为2-1=1、${\;}_{1}^{2}$H的中子数为3-1=2、${\;}_{12}^{23}$Mg的中子数为23-12=11、${\;}_{12}^{24}$Mg的中子数为24-12=12、${\;}_{29}^{65}$Cu的中子数为65-29=26,中子数最多的是${\;}_{29}^{65}$Cu;
故答案为:3;6;${\;}_{29}^{65}$Cu.
点评 本题考查元素和核素的概念,质量数、质子数、中子数与电子数的关系,难度不大.

练习册系列答案
相关题目
1.NaCl晶体的结构中,与每个钠离子距离最近且相等距离的Cl-所围成的空间构型为( )
| A. | 简单立方 | B. | 正四面体 | C. | 正八面体 | D. | 三角锥形 |
6.一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷和氧气,电极反应为:C2H6+18OH--14e-═2CO${\;}_{3}^{2-}$+12H20;7H2O+$\frac{7}{2}$O2+14e-═14OH-.有关此电池的推断错误的是( )
| A. | 通乙烷的电极为负极 | |
| B. | 参加反应的O2与C2H6的物质的量之比为7:2 | |
| C. | 放电一段时间后,KOH的物质的量浓度将下降 | |
| D. | 在电解质溶液中CO${\;}_{3}^{2-}$向正极移动 |
16.下列有关粒子半径的叙述正确的是( )
| A. | 电子层结构相同的粒子随核电荷的递增半径逐渐增大 | |
| B. | CsCl、NaBr、CaF2、LiI四种化合物中LiI的阴阳离子半径之比值最大 | |
| C. | S2-半径小于硫原子半径 | |
| D. | 无法比较K+、Al3+、O2-、Cl-的半径大小 |
3.下面判断不正确的是( )
| A. | 二氧化硫是可燃性气体,因它能与O2反应 | |
| B. | FeSO4可以作为净水剂 | |
| C. | 洒落在地上的汞可在其表面撒硫磺除去 | |
| D. | 重晶石是硫酸盐 |
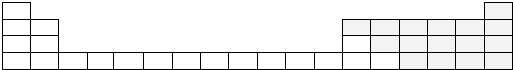
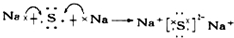 .
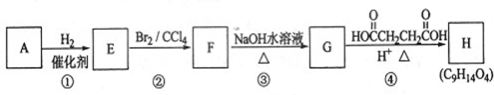
.
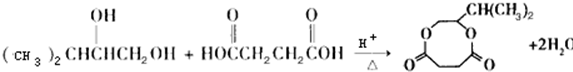 ;
;