题目内容
【题目】水是自然界中普遍存在的一种物质,也是维持生命活动所必需的一种物质。
信息一:水的性质存在许多反常现象,如固态密度小于液态密度使冰浮在水面上,沸点相对较高使水在常温常压下呈液态等。
信息二:在20 ℃、1个大气压下,水可以结成冰,称为“热冰”(如下图):
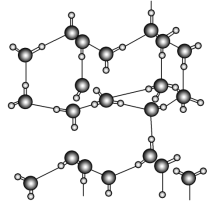
试根据以上信息回答下列问题:
(1)s轨道与s轨道重叠形成的共价键可用符号表示为ds-s,p轨道以“头碰头”方式重叠形成的共价键可用符号表示为dp-p,则H2O分子中含有的共价键用符号表示为________。
(2)下列物质熔化时,所克服的微粒间的作用与“热冰”熔化时所克服的作用类型完全相同的是________。
A 金刚石 B 干冰 C 食盐 D 固态氨
(3)已知:2H2O=H3O++OH-,H3O+的立体构型是________,H3O+中含有一种特殊的共价键是________。
(4)根据等电子原理,写出短周期元素原子形成的与H3O+互为等电子体的分子或离子________。
(5)水的分解温度远高于其沸点的原因是________________。
(6)从结构的角度分析固态水(冰)的密度小于液态水的密度的原因是_______。
【答案】ds-sp3 D 三角锥形 配位键 NH3 水分解需要破坏分子内部的极性键,水的汽化只需破坏分子间的范德华力与氢键即可,而极性键远比分子间的范德华力与氢键强得多 水分子之间除了范德华力外还存在较强的氢键,氢键是有方向性和饱和性的,水由液态变为固态时,氢键的这种方向性和饱和性表现得更为突出,每个水分子都处于与直接相邻的4个水分子构成的四面体中心,分子之间的空隙较大,密度较小
【解析】
本题考察轨道杂化类型、晶体所含的作用力、离子的空间构型、等电子体、氢键和化学键的比较。
(1)H原子只有一个电子,且占据s轨道,O原子通过杂化形成4个sp3杂化轨道,杂化轨道上有2个不成对电子,H原子的s轨道与O原子的sp3杂化轨道头碰头形成共价键,则H2O分子中含有的共价键用符号表示为ds-sp3;
(2)热冰属于分子晶体,其熔化时所克服的作用有分子间作用力和氢键;
A. 金刚石属于原子晶体,熔化需要克服共价键,A错误;
B. 干冰属于分子晶体,熔化需要克服分子间作用力,B错误;
C. 食盐属于离子晶体,熔化需要克服离子键,C错误;
D. 固态氨属于分子晶体,熔化需要克服分子间作用力和氢键,D正确;
故合理选项为D;
(3)H2O的结构本为V形,O含有两对孤电子,H+具有空轨道,可以以配位键的形式,结合其中一对孤电子形成H3O+,则该离子的空间结构为三角锥形;
(4)等电子体的要求是原子总数相同,价电子总数相同,所以短周期元素原子形成的与H3O+互为等电子体的分子或离子有NH3;
(5)水的分解温度远高于其沸点的原因是水分解需要破坏分子内部的极性键,水的汽化只需破坏分子间的范德华力与氢键即可,而极性键远比分子间的范德华力与氢键强得多;
(6)水分子之间除了范德华力外还存在较强的氢键,氢键是有方向性和饱和性的,水由液态变为固态时,氢键的这种方向性和饱和性表现得更为突出,每个水分子都处于与直接相邻的4个水分子构成的四面体中心,分子之间的空隙较大,密度较小。

【题目】300℃时,将气体X和气体Y各1.6 mol充入10 L恒容密闭容器中,发生反应:X(g) +Y(g)2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
回答下列问题:
(1)反应0~2 min Z的平均速率v(Z)=________________
(2)温度为300℃时,该反应的化学平衡常数K=____________________
(3)右图表示该反应变化过程中物质的浓度与反应的时间变化关系。图中t2→t3间的曲线变化是由于下列哪种条件的改变所引起的_______
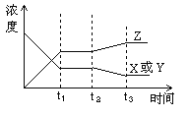
A.增大了压强 B.降低温度
C.增加了x和y的浓度 D.使用了催化剂
(4)若起始时向该容器中充入X、Y、Z各2.0 mol,则反应将向_______(填“正”或“逆”)反应方向进行,达平衡时Z的体积分数=____________,平衡时n(Y)=_______________。