题目内容
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 10gNH3含有4NA个电子
B. 0.1mol铁和0.1mol铜分别与0.1 mol氯气完全反应,转移的电子数均为0.2NA
C. 标准状况下,22.4 L H2O中分子数为NA 个
D. 1L0.1mol·L-1Na2CO3溶液中含有0.1NA个CO32-
【答案】B
【解析】
A.NH3的相对分子质量是17,每个分子中含有10个电子,所以10gNH3含有电子的个数是:(10g÷17g/mol)×10NA=5.88NA个电子,错误;
B.Fe是变价金属,与氯气发生反应:2Fe+3Cl2 ![]() 2FeCl3 ,根据反应方程式中两者的关系可知0.1mol的Cl2与Fe反应时,氯气不足量,所以反应转移的电子的物质的量应该以Cl2为标准,转移的电子数为0.2NA,Cu与Cl2发生反应产生CuCl2,0.1mol铜分别与0.1 mol氯气完全反应,转移的电子数均为0.2NA,正确;
2FeCl3 ,根据反应方程式中两者的关系可知0.1mol的Cl2与Fe反应时,氯气不足量,所以反应转移的电子的物质的量应该以Cl2为标准,转移的电子数为0.2NA,Cu与Cl2发生反应产生CuCl2,0.1mol铜分别与0.1 mol氯气完全反应,转移的电子数均为0.2NA,正确;
C.标准状况下H2O是液体,不能使用气体摩尔体积计算H2O的物质的量,错误;
D.Na2CO3是强碱弱酸盐,在溶液中CO32-发生水解反应而消耗,所以1L0.1mol·L-1Na2CO3溶液中含有CO32-小于0.1NA个,错误;
答案选B。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案【题目】某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。
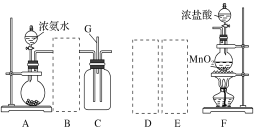
请回答下列问题:
(1)装置A中的烧瓶内固体可选用________(填字母)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(2)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
备选装置 | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
B:________、D:________、E:________。
(3)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:_______
(4)装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案确定该白色固体中的阳离子:________________