题目内容
12.如图的虚线框中每一列、每一行相当于周期表的每一族和每一周期,但它的列数和行数都多于元素周期表.
I.请在如图的虚线框中用实线画出周期表第一至第六周期的轮廓,并画出金属与非金属的分界线.(要求:左上角的第一个格是第一周期第IA族元素)
II.X、Y、Z、M、N为短周期的五种主族元素,其中X、Z同主族,Y、Z同周期,M与X,Y既不同族,也不同周期.X原子最外层电子数是核外电子层数的三倍,Y的最高化合价与其最低化合价的代数和等于6.N是短周期主族元素中原子半径最大的非金属元素.
(1)请写出下列元素的元素符号:XO,YCl,MH.
(2)请写出N元素在周期表中的位置三周期、IVA 主族;与N同族的短周期元素L,其最高价氧化物的电子式为
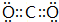 ;N的最高价氧化物与NaOH溶液反应离子方程式:SiO2+2OH-=SiO32-+H2O.
;N的最高价氧化物与NaOH溶液反应离子方程式:SiO2+2OH-=SiO32-+H2O.(3)Y与Z的最高价氧化物的水化物的酸性强弱HClO4>H2SO4(用化学式表示) Y与Z相比,非金属性较强的元素是HCl,可以证明该结论的实验是(用化学方程式表示)Cl2+H2S=S↓+2HCl.
(4)L和M 按1:4的原子个数组成的化合物甲与 X的常见气态单质乙以及NaOH溶液构成原电池,如图,试分析:

①闭合K,写出左侧A电极的反应式CH4+10OH--8e-=CO32-+7H2O
②闭合K,当A电极消耗1.6g化合物甲时(假设过程中无任何损失),则右侧装置中电极上放出的气体在标准状况下的体积为9.96升.
分析 I.第一周期有2种元素,分别处于1、18列,第二、三周期中3~12列不存在,最外层电子数≤周期数为金属元素,第一周期没有金属元素;
Ⅱ.X、Y、Z、M、N为短周期的五种主族元素,X原子最外层电子数是核外电子层数的三倍,原子只能有2个电子层,最外层电子数为6,则X为O元素;X、Z同主族,则Z为S元素;Y、Z同周期,Y的最高化合价与其最低化合价的代数和等于6,则Y为Cl;N是短周期主族元素中原子半径最大的非金属元素,则N为Si;M与X、Y既不同族,也不同周期,则M为H元素,据此解答.
解答 解:I.第一周期有2种元素,分别处于1、18列,第二、三周期中3~12列不存在,最外层电子数≤周期数为金属元素,第一周期没有金属元素,用实线画出周期表第一至第六周期的轮廓,并画出金属与非金属的分界线为: ,
,
故答案为: ;
;
Ⅱ.X、Y、Z、M、N为短周期的五种主族元素,X原子最外层电子数是核外电子层数的三倍,原子只能有2个电子层,最外层电子数为6,则X为O元素;X、Z同主族,则Z为S元素;Y、Z同周期,Y的最高化合价与其最低化合价的代数和等于6,则Y为Cl;N是短周期主族元素中原子半径最大的非金属元素,则N为Si;M与X、Y既不同族,也不同周期,则M为H元素.
(1)由上述分析可知,X为O、Y为Cl、M为H,故答案为:O;Cl;H;
(2)N为Si元素,在周期表中的位置是第三周期IVA族,与N同族的短周期元素L为碳元素,其最高价氧化物为CO2,电子式为 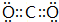 ;N的最高价氧化物为SiO2,与NaOH溶液反应离子方程式:SiO2+2OH-=SiO32-+H2O,
;N的最高价氧化物为SiO2,与NaOH溶液反应离子方程式:SiO2+2OH-=SiO32-+H2O,
故答案为:三;IVA;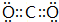 ;SiO2+2OH-=SiO32-+H2O;
;SiO2+2OH-=SiO32-+H2O;
(3)非金属性Y(Cl)>Z(S),最高价氧化物的水化物的酸性:HClO4>H2SO4,可以证明Cl元素非金属性强的实验是(用化学方程式表示):Cl2+H2S=S↓+2HCl,
故答案为:HClO4>H2SO4;Cl;Cl2+H2S=S↓+2HCl;
(4)①闭合K,左侧通入甲烷,而甲烷发生氧化反应,碱性条件下生成碳酸根离子与水,左侧A电极的反应式:CH4+10OH--8e-=CO32-+7H2O,
故答案为:CH4+10OH--8e-=CO32-+7H2O;
②闭合K,当A电极消耗1.6g甲烷,其物质的量=$\frac{1.6g}{16g/mol}$=0.1mol,转移电子物质的量=0.1mol×8=0.8mol,右池为电解池,阴离子只有氢氧根离子放电生成氧气,根据电子转移守恒可知,生成氧气的物质的量=$\frac{0.8mol}{4}$=0.2mol,溶液中Ag+的物质的量=0.2L×2mol/L=0.4mol,完全放电转移获得电子为0.4mol,故反应的H+的物质的量=0.8mol-0.4mol=0.4mol,故生成氢气的物质的量=$\frac{0.4mol}{2}$=0.2mol,故共得到气体体积=(0.2mol+0.2mol)×22.4L/mol=8.96L,
故答案为:8.96.
点评 本题考查结构性质位置关系应用,涉及元素周期表、元素周期律、电子式、化学计算、电化学等,题目比较综合,推断元素是解题的关键,注意利用电子转移守恒计算原电池、电解池的有关计算,难度中等.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案| A. | 可吸入颗粒(如硅酸盐粉尘),吸入人体,对人体健康危害极大 | |
| B. | 土壤表面积巨大且一般带负电,能吸收NH4+等营养离子,使土壤具有保肥能力 | |
| C. | 水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染 | |
| D. | 氯化铝溶液中加入碳酸钠溶液会出现白色沉淀 |
| A. | 向CaCl2溶液中通入CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 漂白粉溶液中通入过量SO2:ClOˉ+H2O+SO2═HSO3-+HClO | |
| C. | 在FeSO4溶液中加入H2O2溶液:Fe2++2H2O2+4H+═Fe3++4H2O | |
| D. | 在澄清石灰水中加入少量小苏打溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| A. | 6mol | B. | 5mol | C. | 4mol | D. | 3mol |
| A. | 碳酸氢钠溶液与少量石灰水反应:HCO3-+OH-+Ca2+═H2O+CaCO3↓ | |
| B. | 氯化铵与氢氧化钠溶液混合:NH4++OH-═H2O+NH3↑ | |
| C. | 向漂白粉溶于水形成的溶液中通入少量的SO2:Ca2++3ClO-+SO2+H2O═CaSO4↓+Cl-+2HClO | |
| D. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ |
| A. | 自来水中通入Cl2用于杀菌、消毒是利用HClO的性质 | |
| B. | 用氯气消毒过的水可用于配制澄清石灰水溶液 | |
| C. | 氯水、液氯、氯气的成分相同,Cl2和Cl-的化学性质也相同 | |
| D. | 久制的氯水呈无色,但仍然有漂白、杀菌的功能 |
| A. | V1>V2>V3 | B. | V1>V3>V2 | C. | V3>V2>V1 | D. | V3>V1>V2 |
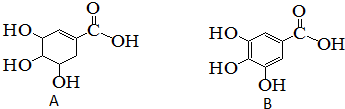
| A. | 化合物A和B遇三氯化铁溶液都显紫色 | |
| B. | 化合物A和B中所含官能团相同 | |
| C. | 等物质的量的A和B分别与足量的NaOH溶液反应,消耗NaOH的量相同 | |
| D. | 化合物A和B都能与溴水反应 |