题目内容
6.下列分子中所有原子都满足最外层为8电子结构的是( )| A. | CCl4 | B. | BF3 | C. | HClO | D. | H2O |
分析 对于ABn型共价化合物元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构,以此解答该题.
解答 解:A.CCl4中Si元素化合价为+4,C原子最外层电子数为4,所以4+4=8,C原子满足8电子结构;Cl元素化合价为-1,Cl原子最外层电子数为7,所以1+7=8,Cl原子满足8电子结构,故A正确;
B.BF3中B元素化合价为+3,B原子最外层电子数为3,所以3+3=6,B原子不满足8电子结构;F元素化合价为-1,F原子最外层电子数为7,所以1+7=8,F原子满足8电子结构,故B错误;
C.含有H元素,H元素化合价为+1,H原子最外层电子数为1,所以1+1=2,H原子不满足8电子结构,故C错误;
D.H2O中O元素化合价为-2,O原子最外层电子数为6,所以2+6=8,O原子满足8电子结构;H元素化合价为+1,H原子最外层电子数为1,所以1+1=2,H原子不满足8电子结构,故D错误.
故选A.
点评 本题考查8电子结构的判断,难度不大,清楚元素化合价绝对值+元素原子的最外层电子层=8,则该元素原子满足8电子结构是关键,注意离子化合物不适合.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
16.下列中心原子的杂化轨道类型和分子几何构型均正确的是( )
| A. | CS2中C原子sp2杂化,为V形 | |
| B. | BCl3中B原子sp2杂化,为三角锥形 | |
| C. | C2H2分子中,C为sp2杂化,为直线形 | |
| D. | PCl2中P原子sp2杂化,为平面三角形 |
14.已知NaHSO4在水中电离方程式为:NaHSO4=Na++H++SO42-.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,对于该溶液,下列叙述中不正确的是( )
| A. | 该温度高于25℃ | |
| B. | c(H+)=c(OH-)+c(SO42-) | |
| C. | 水电离出来的c(H+)=1×10-10mol•L-1 | |
| D. | 该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好是中性 |
1.一定条件,在水溶液中物质的量均为1mol的Cl-、ClOx-(x=1,2,3,4)几种微粒的能量(kJ)相对大小与氯元素化合价的相互关系如图所示,下列说法正确的是( )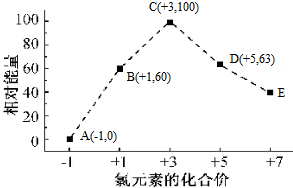

| A. | 所含氯元素的化合价越高,该物质的能量越高 | |
| B. | 所含氯元素的化合价越高,该物质越不稳定 | |
| C. | B→A+D的热化学方程式为3ClO-(aq)=2Cl-(aq)+ClO3-(aq)△H=-117kJ•mol-1 | |
| D. | ClO2-→ClO3-+ClO4-可以自发进行 |
11.能正确表示下列反应的离子方程式是( )
| A. | 用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+2Ag↓+H2O | |
| B. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH- $\stackrel{△}{→}$ CH2BrCOO-+H2O | |
| C. | 稀HNO3洗涤试管中的银镜:3Ag+NO3-+4H+=3Ag++NO↑+2H2O | |
| D. | 向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |
18.化学反应中的能量变化,通常表现为热量的变化,如Ba(OH)2•8H2O 与NH4Cl的反应要吸收热量,在化学上叫作吸热反应.其原因是( )
| A. | 反应物NH4Cl所具有的能量比较低 | |
| B. | 反应物Ba(OH)2•8H2O所具有的能量比较低 | |
| C. | 反应物所具有的总能量高于生成物所具有的总能量 | |
| D. | 反应物所具有的总能量低于生成物所具有的总能量低 |
15.下列四种有机化合物均含有多个官能团,其结构简式如下所示,下面有关说法中正确的是( )
| A. |  属于酚类,可与Na2CO3溶液反应,但不产生CO2 属于酚类,可与Na2CO3溶液反应,但不产生CO2 | |
| B. |  属于酚类,能使FeCl3溶液显紫色 属于酚类,能使FeCl3溶液显紫色 | |
| C. |  1 mol该物质最多能与3mol Br2发生反应 1 mol该物质最多能与3mol Br2发生反应 | |
| D. |  可以发生消去反应 可以发生消去反应 |
16.下列反应中,氨气体现还原性,且既有极性共价键、非极性共价键的断裂和形成是( )
| A. | NH3+HCl═NH4Cl | B. | 8NH3+3Cl2═6NH4Cl+N2 | ||
| C. | 2NH3+2Na═2NaNH2+H2 | D. | 2NH3+3CuO═3Cu+N2+3H2O |

 .
.