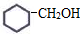题目内容
12.某元素原子M层电子数是K层电子数的3.5倍,则该元素最高价氧化物对应水化物的化学式为( )| A. | HClO4 | B. | HNO3 | C. | H2SO4 | D. | H3PO4 |
分析 某元素原子M层电子数是K层电子数的3.5倍,则该原子M层电子数为7,故M为Cl元素,最高正化合价为+7,据此判断.
解答 解:某元素原子M层电子数是K层电子数的3.5倍,则该原子M层电子数为7,故M为Cl元素,最高正化合价为+7,该元素最高价氧化物对应水化物的化学式为HClO4,故选A.
点评 本题考查原子结构与元素性质,比较基础,关键是根据核外电子排布确定元素,有利于基础知识的巩固.

练习册系列答案
相关题目
20.下列说法中正确的一组是( )
| A. | H2和D2互为同位素 | B. |  和 和  互为同分异构体 互为同分异构体 | ||
| C. | H、D、T互称为同素异形体 | D. |  和 和 是同一种物质 是同一种物质 |
4.如图所示装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是( )


| A. | 若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液褪色 | |
| B. | 若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊 | |
| C. | 若a为浓硫酸,b为Na2SO3固体,c中盛紫色石蕊溶液,则c中溶液变红 | |
| D. | 若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀 |
1.一定条件,在水溶液中物质的量均为1mol的Cl-、ClOx-(x=1,2,3,4)几种微粒的能量(kJ)相对大小与氯元素化合价的相互关系如图所示,下列说法正确的是( )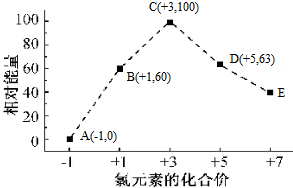

| A. | 所含氯元素的化合价越高,该物质的能量越高 | |
| B. | 所含氯元素的化合价越高,该物质越不稳定 | |
| C. | B→A+D的热化学方程式为3ClO-(aq)=2Cl-(aq)+ClO3-(aq)△H=-117kJ•mol-1 | |
| D. | ClO2-→ClO3-+ClO4-可以自发进行 |


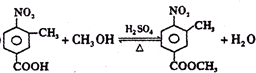 ,使用过量CH3OH的作用是提高D的产率.
,使用过量CH3OH的作用是提高D的产率. .
.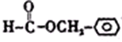 .
.
 .
.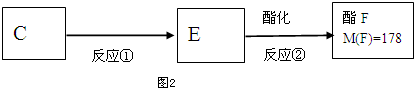
 ,
, ,
, .
. .
.
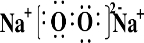 .
. 的系统命名:3,4-二甲基已烷
的系统命名:3,4-二甲基已烷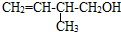 的键线式:
的键线式:
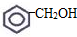 ③
③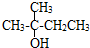 ④
④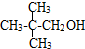 ⑤
⑤ ⑥
⑥