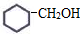题目内容
10.下列叙述中正确的是( )| A. | NH3、CO、CO2都是极性分子 | |
| B. | BF3、SiCl4都是含有极性键的非极性分子 | |
| C. | HF、HCl、HBr、Hl的稳定性依次增强 | |
| D. | CS2、H2O、C2H2都是直线型分子 |
分析 A.CO2属于直线形分子,结构对称,正负电荷中心重叠;
B.BF3属于平面三角形分子,SiCl4属于正四面体分子,结构对称,正负电荷中心重叠;
C.非金属性越强,其氢氧化物的稳定性越强;
D.H2O是V形分子.
解答 解:A.CO2属于直线形分子,结构对称,正负电荷中心重叠,属于非极性分子,NH3、CO属于极性分子,故A错误;
B.BF3属于平面三角形分子,SiCl4属于正四面体分子,结构对称,正负电荷中心重叠,属于非极性分子,分子中均含有极性键,故B正确;
C.非金属性越强,其氢氧化物的稳定性越强,非金属性:F>Cl>Br>I,则HF、HCl、HBr、Hl的稳定性依次减弱,故C错误;
D.H2O是V形分子,CS2、C2H2都是直线型分子,故D错误.
故选B.
点评 本题考查了分子的极性、共价键的极性,题目难度不大,注意把握常见分子的构型.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列说法中正确的一组是( )
| A. | H2和D2互为同位素 | B. |  和 和  互为同分异构体 互为同分异构体 | ||
| C. | H、D、T互称为同素异形体 | D. |  和 和 是同一种物质 是同一种物质 |
1.一定条件,在水溶液中物质的量均为1mol的Cl-、ClOx-(x=1,2,3,4)几种微粒的能量(kJ)相对大小与氯元素化合价的相互关系如图所示,下列说法正确的是( )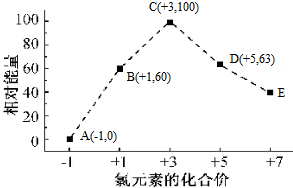

| A. | 所含氯元素的化合价越高,该物质的能量越高 | |
| B. | 所含氯元素的化合价越高,该物质越不稳定 | |
| C. | B→A+D的热化学方程式为3ClO-(aq)=2Cl-(aq)+ClO3-(aq)△H=-117kJ•mol-1 | |
| D. | ClO2-→ClO3-+ClO4-可以自发进行 |
18.化学反应中的能量变化,通常表现为热量的变化,如Ba(OH)2•8H2O 与NH4Cl的反应要吸收热量,在化学上叫作吸热反应.其原因是( )
| A. | 反应物NH4Cl所具有的能量比较低 | |
| B. | 反应物Ba(OH)2•8H2O所具有的能量比较低 | |
| C. | 反应物所具有的总能量高于生成物所具有的总能量 | |
| D. | 反应物所具有的总能量低于生成物所具有的总能量低 |
5.实验室制取氯气应该选用哪一套装置( )
| A. |  | B. |  | C. |  |
15.下列四种有机化合物均含有多个官能团,其结构简式如下所示,下面有关说法中正确的是( )
| A. |  属于酚类,可与Na2CO3溶液反应,但不产生CO2 属于酚类,可与Na2CO3溶液反应,但不产生CO2 | |
| B. |  属于酚类,能使FeCl3溶液显紫色 属于酚类,能使FeCl3溶液显紫色 | |
| C. |  1 mol该物质最多能与3mol Br2发生反应 1 mol该物质最多能与3mol Br2发生反应 | |
| D. |  可以发生消去反应 可以发生消去反应 |
19.在下列有关晶体的叙述中错误的是( )
| A. | 稀有气体的原子能形成分子晶体 | B. | 离子晶体中,一定存在离子键 | ||
| C. | 原子晶体中,只存在共价键 | D. | 金属晶体的熔沸点均很高 |
20.下列关于接触法制硫酸的叙述中,正确的是( )
| A. | 用硫代替硫铁矿可以避免对环境的污染 | |
| B. | 接触室中的热交换器是为预热反应物和冷却生成物、节约能量而设计的 | |
| C. | 吸收塔中气体和浓H2SO4一起从塔顶端进入生成成品酸 | |
| D. | 用水吸收SO3使之成为硫酸 |
 的系统命名:3,4-二甲基已烷
的系统命名:3,4-二甲基已烷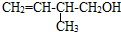 的键线式:
的键线式:
 ③
③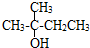 ④
④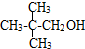 ⑤
⑤ ⑥
⑥