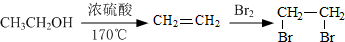题目内容
12.四种常见元素的相关信息如下表所示,请回答下列问题:| 元素 | X | Y | Z | W |
| 相关信息 | 短周期p区元素,有种单质常作电极材料 | 基态原子2p能级上各轨道中均有电子且电子的自旋方向相同 | 基态原子的核外电子共有17种运动状态 | 位于第四周期第VA族 |
(2)Z能与X、Y、W形成XZ4、YZ3、WZ3、WZ5等化合物,其中中心原子杂化方式为sp3的分子是CCl4、NCl3、AsCl3(填化学式,下同),分子构型为正四面体的是CCl4.
(3)Y、Z及氢、铂元素可组成为Pt(YH3)2Z2的配合物,该配合物存在两种不同的结构:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大.
①Q是非极性分子(填“极性”或“非极性”).
②P分子的结构简式为
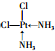 (YH3作为一个整体写)
(YH3作为一个整体写)(4)X的一种单质分子(N)的球棍模型如图1所示,该分子中每个X原子均形成了稳定的8电子结构,则分子中σ键与π键数目之比为3:1.一定条件下含NA个X原子的N与足量氢气发生加成反应时,消耗1gH2
(5)W与镓的化合物(GaW)是一种半导体材料,其晶胞结构如图2所示,镓原子的配位数是4,该晶胞的密度为ρg•cm-3,则该晶胞的边长为$\root{3}{\frac{580}{ρ•{N}_{A}}}$cm(用含NA、ρ的代数式表示).

图1 图2.
分析 X为短周期p区元素,有种单质常作电极材料,则X为C元素;Y的基态原子2p能级上各轨道中均有电子且电子的自旋方向相同,则Y的2p轨道含有3个电子,为N元素;Z基态原子的核外电子共有17种运动状态,其原子的核外电子总数17,则Z为Cl元素;W位于第四周期第VA族,则W为As元素,据此结合元素周期律知识进行解答.
解答 解:X为短周期p区元素,有种单质常作电极材料,则X为C元素;Y的基态原子2p能级上各轨道中均有电子且电子的自旋方向相同,则Y的2p轨道含有3个电子,为N元素;Z基态原子的核外电子共有17种运动状态,其原子的核外电子总数17,则Z为Cl元素;W位于第四周期第VA族,则W为As元素,
(1)As是35号元素,属于主族元素,其最外层电子就是其价电子,所以As基态原子的价电子排布式:4s24p3;Cl的非金属性大于As,则第一电离能大小为:Cl>As,
故答案为:4s24p3;Cl>As;
(2)Cl能与C、N、As形成CCl4、NCl3、AsCl3、AsCl5等化合物,其中CCl4形成4个C-Clσ键键,NCl3、AsCl3中含有3个σ键和1对孤电子对,所以它们的中心原子的杂化方式为sp3,而AsCl5中As含有5个As-Cl键,不是sp3杂化;其中NCl3、AsCl3为V形,分子构型为正四面体的为CCl4,
故答案为:CCl4、NCl3、AsCl3;CCl4;
(3)①Pt(YH3)2Z2为PtCl2(NH3)2,根据相似相溶原理,因为淡黄色固体Q,较难溶于极性溶剂水,则Q为非金属性分子,
故答案为:非极性分子;
②通过相似相溶原理可知两种固体一种为极性分子,另一种为非极性分子,若PtCl2(NH3)2为四面体结构,只能为极性分子,故只能为平面正方形结构,黄绿色(P)在水中的溶解度较大,则P为极性分子,其结构简式为: ,
,
故答案为: ;
;
(4)X为C元素,每个原子最外层都满足8电子稳定结构,根据图示可知,每个C原子形成了3个键,则每个C形成的这3个键中,必然有1个双键,这样每个C原子最外层才满足8电子稳定结构,双键数应该是C原子数的一半,而双键中有1个σ键、1个π键,所以分子中σ键与π键数目之比为3:1;
一定条件下含NA个C原子的N中含有C原子的物质的量为:$\frac{N}{{N}_{A}}$mol=1mol,含有碳碳双键的数目为:1mol×$\frac{1}{2}$=0.5mol,0.5mol碳碳双键完全反应消耗0.5mol氢气,消耗氢气的质量为:2g/mol×0.5mol=1g,
故答案为:3:1;1;
(5)根据化学式GaAs可知,晶胞中Ga和As的配位数相同,根据图示可知,每个As连接了4个Ga,则Ga和As的配位数都是4;Ga原子位于立方体的顶点和面心,每个晶胞中含有Ga数目为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则同时含有4个As;每个晶胞的质量为:4×$\frac{145}{{N}_{A}}$g=$\frac{580}{{N}_{A}}$g,该晶胞的密度为ρg•cm-3,则该晶胞的体积为:V=$\frac{\frac{580}{{N}_{A}}g}{ρg•c{m}^{-3}}$=$\frac{580}{ρ•{N}_{A}}$cm3,所以该晶胞的边长为:$\root{3}{\frac{580}{ρ•{N}_{A}}}$,
故答案:4;$\root{3}{\frac{580}{ρ•{N}_{A}}}$.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度较大,注意掌握原子结构与元素周期律、元素周期表的关系,(5)为难点,注意掌握晶胞中密度、边长的计算方法.

| A. | 光化学烟雾是氮氧化物受紫外线照射后与空气中的一些碳氢化合物作用后生成的一种有毒烟雾 | |
| B. | 以粮食为原料酿酒过程的变化包括粮食→淀粉→葡萄糖→乙醇 | |
| C. | 航天飞机上使用的隔热陶瓷瓦,大多是以碳纤维做增强体的新型复合材料 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
| A. | S2-和HS- | B. | H3O+和OH- | C. | Na+和NH${\;}_{4}^{+}$ | D. | K+和Ne |
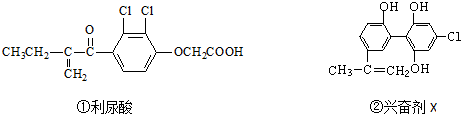
则关于它们的说法中正确的是( )
| A. | 利尿酸分子中有三种含氧官能团,在核磁共振氢谱上共有六个峰 | |
| B. | 1 mol兴奋剂X与足量浓溴水反应,最多消耗4 mol Br2 | |
| C. | 两种兴奋剂最多都能和含3molNaOH的溶液反应 | |
| D. | 两种分子中的所有碳原子均不可能共平面 |
| A. | 2A(l)+B(l)=2C(l)△H1 2A (g)+B(g)=2C(l)△H2 则△H1>△H2 | |
| B. | 31g红磷变成31g白磷要吸收能量,说明红磷比白磷更稳定 | |
| C. | 测定HCl和NaOH的中和热时,每次实验均应测量三个温度,即盐酸的起始温度、NaOH的起始温度和反应结束后稳定的温度 | |
| D. | 在101 kPa时,已知氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ/mol |
| A. | 碳酸钙受热分解 | B. | 乙醇燃烧 | ||
| C. | 铝粉与盐酸的反应 | D. | 氧化钙溶于水 |
| A. | 构成原电池正极和负极的材料必须是两种金属 | |
| B. | 由铜、锌电极与硫酸铜溶液组成的原电池中铜是负极 | |
| C. | 电子由锌片流经稀硫酸溶液到铜片,氢离子在铜片上得到电子放出氢气 | |
| D. | 铜锌原电池工作时,若有13g锌被溶解,电路中就有0.4mol电子通过 |
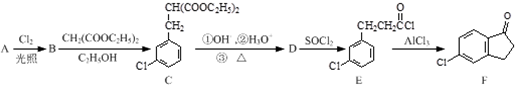
 ,反应E→F的反应类型取代反应.
,反应E→F的反应类型取代反应.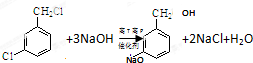 .
. 或
或 (任写一种).
(任写一种).
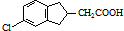 的合成路线流程图(注明反应条件).合成路线流程图示例如下:
的合成路线流程图(注明反应条件).合成路线流程图示例如下: