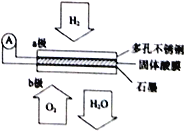
题目内容
【题目】设Na为阿伏加德罗常数的值。已知反应:
①CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) △H1 =a kJ mol -1
②CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) △H2 =bkJ mol-1
键能定义:在标准状况下,将1 mol气态分子AB(g)解离为气态原子
A(g)、B(g)所需的能量。已知1 mol氧气的键能为xkJ。其他数据如下 表所示,下列说法正确的是
化学键 | C—O | C—H | O—H |
键能/(kJ mol-1) | 798 | 413 | 463 |
A.上文中x=![]()
B.H2O(g) = H2O(1)的△S<0、△H=(a — b) kJ mol -1
C.当有4NA个O—H键生成时,反应放出的热量为a kJ
D.利用反应①设计的原电池电解精炼铜,当负极输出0.2NA个电子时. 理论上电解槽的阴极质量增重6.4 g
【答案】D
【解析】
A. 根据反应①可知,△H1=413kJ/mol×4+2xkJ/mol(798×2+463×4)kJ/mol=akJ/mol,整理可得:x=![]() ,故A错误;
,故A错误;
B. ①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=akJ/mol、②CH4(g)+2O2(g)═CO2(g)+2H2O(g)
△H2=bkJ/mol,根据盖斯定律![]() (①②)可得:H2O(g)═H2O(l)△H=
(①②)可得:H2O(g)═H2O(l)△H=![]() (ba)kJ/mol,故B错误;
(ba)kJ/mol,故B错误;
C. 有4NA个CH键断裂时,反应消耗了1mol甲烷,若按照反应①进行,放热热量为akJ,若按照反应②进行,放热热量为bkJ,故C错误;
D. 电解精炼铜时,当负极输出0.2NA个电子时,转移电子的物质的量为0.2mol,阴极上铜离子得电子生成铜单质,生成铜的物质的量为![]() =0.1mol,质量为:64g/mol×0.1mol=6.4g,故D正确;
=0.1mol,质量为:64g/mol×0.1mol=6.4g,故D正确;
答案选D。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案